-
下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
难度: 中等查看答案及解析
-
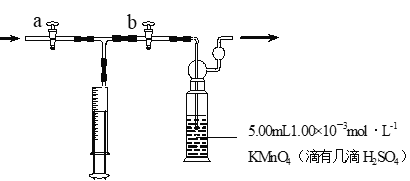
下列实验操作和数据记录都正确的是
A. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL
C. 用10 mL量筒量取8.25 mL盐酸
D. 用pH试纸测得某溶液pH为3.2
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定环境中一定能大量共存的是( )
A. pH=1的无色溶液SO42-、Cu2+、Na+、Cl-
B. 使石蕊试纸变蓝的溶液:Na+、K+、S2-、 CO32-
C. 加入铝粉能产生H2的溶液中: NH4+、Na+、Fe2+、 NO3-
D. 水电离出的c(H+)=1.0×
mol/L的溶液中:K+、Na+、Cl-、 HCO3-
难度: 简单查看答案及解析
-
同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是①纯锌片;②粗锌片;③0.01 mol/L盐酸;④0.01 mol/L硫酸;⑤98%硫酸;⑥加热;⑦用冰水冷却( )
A. ①③⑦ B. ②④⑥ C. ②③⑥ D. ①⑤⑥
难度: 简单查看答案及解析
-
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A、KNO3盐桥中的K+移向Cu(NO3)2溶液
B、Cu作负极,发生还原反应
C、电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D、工作一段时间后,AgNO3溶液中c(Ag+)减小
难度: 中等查看答案及解析
-
LiFePO4新型锂离子动力电池是奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4,负极 Li-e-==Li+下列说法中正确的是
A. 充电时电池反应为FePO4+Li = LiFePO4
B. 充电时动力电池上标注“+”的电极应与外接电源的正极相连
C. 放电时电池内部Li+向负极移动
D. 放电时,在正极上是Li+得电子被还原
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 0.2 mol•L﹣1的NaHCO3溶液中:c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣)
B. 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl﹣)
D. pH=1的NaHSO4溶液:c(H+)= c(SO42﹣)十c(OH﹣)
难度: 困难查看答案及解析
-
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )
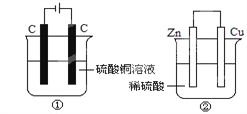
A. 产生气体体积①=②
B. 电极上析出固体质量①<②
C. 溶液的pH变化:①减小②增大
D. 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+
难度: 中等查看答案及解析
-
25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
难度: 困难查看答案及解析
-
在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:2NO(g)+C(s)
N2 (g)+CO2 (g) ΔH=-Q kJ/mol (Q>0),达到平衡时的数据如下,下列有关说法正确的是
温度/℃
n(C)/mol
n(CO2)/mol
T1
0. 15
T2
0. 375
A. 由上述信息可推知:T1>T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c(N2)∶c(NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数K=9/16
难度: 中等查看答案及解析
-
将某一元弱酸(HA)和氢氧化钠溶液混合后溶液呈中性,则此溶液中c(Na+)与c(A-)的关系为( )
A. c(Na+)=c(A-) B. c(Na+)<c(A-) C. c(Na+)>c(A-) D. 无法确定
难度: 简单查看答案及解析
-
在t ℃下,某反应达到平衡,平衡常数
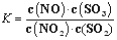 。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是( )A. 该反应正反应的焓变为正值 B. 恒温下扩大容器体积,反应体系的颜色加深
C. 升高温度,逆反应速率减小 D. 该反应化学方程式为NO2+SO2
NO+SO3
难度: 中等查看答案及解析
-
25℃时,向盛有50 mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
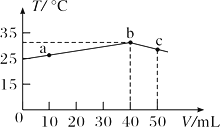
A. HA溶液的物质的量浓度为0.0l mol/L
B. a→b的过程中,混合溶液不可能存在:c(A-)=c(Na+)
C. b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应
D. 25℃时,HA的电离平衡常数K约为1.25×10—6
难度: 中等查看答案及解析
-
下列实验现象及结论正确的是
A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP (AgCl)> KSP (AgI)
B. Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka: H2CO3>H3BO3
C. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者
D. 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者
难度: 中等查看答案及解析
-
已知某温度下,MnCO3、MnS的溶度积分别为2.0×10 -11、5.0×10 -14。下列推断不正确的是 ( )
A. 碳酸锰的溶解度大于硫化锰的溶解度
B. 碳酸锰转化成硫化锰的离子方程式为MnCO3(s)+S2-(aq)
MnS(s)+ CO32-(aq)
C. 碳酸锰转化成硫化锰的平衡常数K=2.5×10-3
D. 在含相同浓度的CO32一,S2-的溶液中滴加氯化锰溶液,先产生沉淀是MnS
难度: 中等查看答案及解析
-
有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1 mol NO2 ,Ⅱ中加入2 mol NO2 ,都将发生反应2NO2(g)
N2O4(g),反应达到平衡时,测得Ⅰ中NO2 的转化率为a%,Ⅱ中NO2 的转化率为b%,则a、b的关系为
A. a<b B. a>b C. a=b D. 无法确定
难度: 中等查看答案及解析
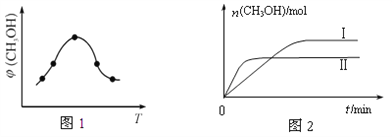
 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示: