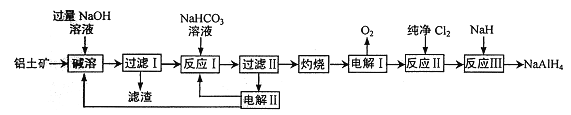
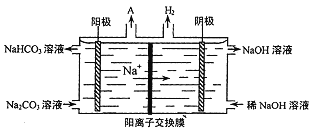
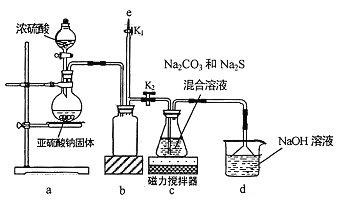
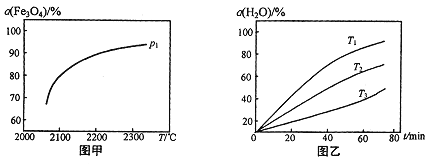
-
下列有关说法错误的是
A. 使用含有氯化钙的融雪剂会加快桥梁的腐蚀
B. 为使鲜花保鲜,可在箱内放入高锰酸钾溶液浸泡过的硅藻土
C. 雾霾是一种分散系,戴活性炭口罩的原理是吸附作用
D. 常用危险化学品标志中的数字主要表示的是危险的级别
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 钛被称为继铁、铝之后的第三金属,但目前主要用于尖端领域,是因为其制备或冶炼的成本远高于铁或铝
B. 配制一定物质的量浓度的溶液时,固体溶解后未冷却就立即转移到容量瓶中定容,会使所配溶液浓度偏大
C. 用酒精灯加热铝箔可使铝箔熔化,但熔化的铝并不滴落,是因为构成铝表面薄膜的氧化铝的熔点高于铝的熔点
D. 胶体粒子的直径大于可见光的波长,能使光波发生散射
难度: 中等查看答案及解析
-
苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图,下列说法不正确的是
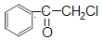
A. 分子式为C8H7OCl
B. 在同一平面上的碳原子最多有8个
C. 1摩尔苯氯乙酮最多可与3摩尔氢气发生加成反应
D. 不存在与它同一类别的同分异构体
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1molO2完全反应时,转移的电子数一定为0:4NA
B. 在标准状况下,1molSO3体积约为22.4 L
C. 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA
D. 1mol 葡萄糖与足量的钠反应能产生2.5molH2
难度: 困难查看答案及解析
-
下列评价合理的是
选项
离子方程式或实验操作与现象
评价
A
FeBr2溶液与等物质的量的Cl2反应: 2 Fe2++2 Br-+2 Cl2=2 Fe3++4 Cl-+Br2
错误
B
向碳酸镁中加入稀盐酸: CO32-+2 H+=CO2↑+H2O
错误
C
将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色
H2O2 的氧化性比Fe3+强
D
向淀粉溶液中加入稀H2SO4,加热一段时间,冷却后加入新制Cu(OH)2,煮沸,没有生成砖红色沉淀
淀粉未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是

A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
难度: 中等查看答案及解析
-
m、n、p、q 为原子序数依次增大的短周期主族元素,四种原子最外层电子数之和为18,n3-与p2+ 具有相同的电子层结构。下列叙述中错误的是
A. m、n、q一定是非金属元素
B. 氢化物的沸点: q>n>m
C. 离子半径的大小: q>n>p
D. m 与q形成的二元化合物一定是共价化合物
难度: 困难查看答案及解析