-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及实验现象
结论
A
室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去
溶液中含有Fe2+,不含Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊
Na2O2已经变质
D
向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀
Ksp(AgCl)<Ksp(Ag2CrO4)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与生产、生活及社会发展密切相关,下列有关说法不正确的是( )
A. “血液透析”和“静电除尘”利用了胶体的不同性质
B. 把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C. 酸性重铬酸钾用于检查酒驾是利用其强还原性
D. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. lmolSO2和0.5mo1O2在VL的密闭容器中充分反应,生成SO3的分子数目为NA
C. 1molFe与足量氯气反应时转移的电子数为3NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
难度: 中等查看答案及解析
-
化合物
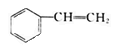 (x)、
(x)、(y)、
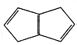 (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是A. y 的二氯代物有3 种 B. x、y和z均能与溴水发生反应
C. z 中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
难度: 困难查看答案及解析
-
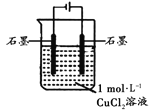
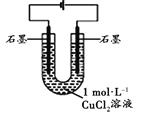
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
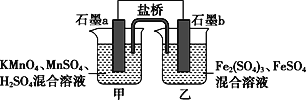
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
难度: 中等查看答案及解析
-
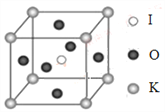
短周期主族元素X、Y、Z、M 的原子序数依次递增,四种原子的最外层电子数之和为20。X与Y、Z、M 位于相邻周期,Z原子最外层电子数是X原子内层电子数的2 倍,Y、Z 相邻,M比X族序数大1。下列说法正确的是( )
A. 简单离子的半径:Y>X B. 简单氢化物的热稳定性:Z>M
C. X和Z可形成ZX2分子 D. 最高价氧化物的水化物酸性:M>Y
难度: 中等查看答案及解析
-
25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[c (H+)/c(OH-)]的关系如图所示(V=0时,
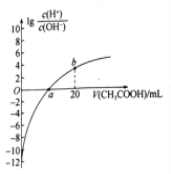
lg[c (H+)/c(OH-)]=-12)。下列说法正确的是( )
A. MOH的电离方程式为MOH
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数为(10/17)×10-9
难度: 困难查看答案及解析