-
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
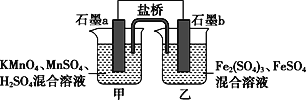
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
-
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
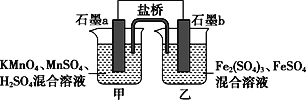
A.石墨b是原电池的负极,发生氧化反应
B.甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C.电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D.忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
-
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
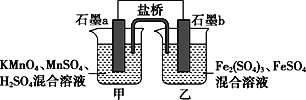
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
-
(10分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是________。________
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是________ 。
②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些化学计量数作限定,可能的配平化学计量数有许多组。原因是________。
-
已知KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )

A.电池工作时,电子移向为石墨Ⅰ→溶液→盐桥→溶液→石墨Ⅱ
B.电池工作时,盐桥中的K+移向甲烧杯
C.甲烧杯中发生的电极反应为Mn2+﹣4e﹣+4H2O═MnO4﹣+8H+
D.电池工作一段时间后乙烧杯中溶液的pH增大
-
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):KMnO4+FeSO4+H2SO4―→K2SO4+MnSO4+Fe2(SO4)3+H2O。下列说法正确的是
A. Fe2+的还原性强于Mn2+
B. MnO4-是氧化剂,Fe3+是还原产物
C. 生成1 mol水时,转移1.25 mol电子
D. 取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成
-
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定

(1)装置④中的x试剂为________。
(2)装置③中发生反应的化学方程式为________。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是________
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”、“偏低”或“无影响”)
-
根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
| ③ | MnO4- ...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中参加反应的Cl2 与 FeBr2的物质的量之比为1:2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
-
根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
| ③ | MnO4- ...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+
-
根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3 、Br2 |
| ③ | MnO2 ...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O
B.第③组反应中生成1mol Cl2,转移电子4mol
C.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ >Br2
D.第②组反应中Cl2 与 FeBr2的物质的量之比为3:2




