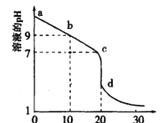
-
下列说法正确的是( )
A. 含有OH-的溶液一定呈碱性
B. pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C. Na2CO3溶液与NaHCO3溶液中所含微粒的种类一定相同
D. pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
难度: 中等查看答案及解析
-
下列电池工作时能量转化形式与其他三个不同的是( )
A. 锌锰干电池

B. 硅太阳能电池

C. 氢氧燃料电池

D. 铅蓄电池

难度: 简单查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验,据此判断四种金属的活动顺序是( )
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。
A. A>C>D>B B. A>B>C>D C. C>A>B>D D. B>D>C>A
难度: 简单查看答案及解析
-
某课外活动小组设计的用化学电源使LED灯发光的装置如图。下列说法错误的是( )

A. 铜片表面有气泡生成,锌片上发生氧化反应
B. 如果将稀硫酸换成葡萄糖溶液,不能使LED灯发光
C. 装置中存在“化学能→电能→光能”的转换
D. 如果将铜片换成铁片,则锌片为正极
难度: 中等查看答案及解析
-
下列说法中不正确的 ( )
A. 废旧电池不能随意丢弃,应回收
B. 由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-===AlO2-+2H2O
C. 充电电池能实现化学能与电能间的相互转化,可以无限次充放电
D. 由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-===Al3+
难度: 简单查看答案及解析
-
如图是某同学设计的原电池装置,下列叙述中正确的是
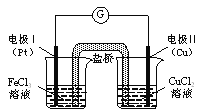
A. 电极Ⅰ上发生还原反应,作原电池的负极
B. 电极Ⅱ的电极反应式为: Cu2++2e-=" Cu"
C. 该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2.则下列说法中正确的是( )
A. 通CO的一极是电池的正极 B. 负极电极反应是:O2+2CO2+4e-=2CO32-
C. 熔融盐中CO32-的物质的量在工作时保持不变 D. 正极发生氧化反应
难度: 中等查看答案及解析
-
按下图装置实验,若x轴表示流出负极的电子的物质的量,则y轴应表示
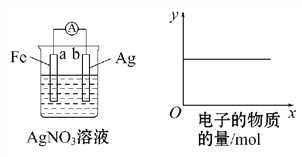
①c(Ag+) ②c(N
) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ①③ B. ③④ C. ①②④ D. ②
难度: 简单查看答案及解析
-
下列实验操作规范且能达到目的的是( )
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B.
除去锅炉中沉积的CaSO4
可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
证明Ksp(ZnS) > Ksp(CuS)
在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列叙述不正确的是( )
A. 氨水中:c(OH-)-c(H+)=c(NH4+)
B. 饱和H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-)
C. 0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D. 在0.1mol/L Na2CO3溶液中:c(Na+)=2[c(HCO3﹣)+c(CO32﹣)+c(H2CO3)]
难度: 简单查看答案及解析
-
有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )
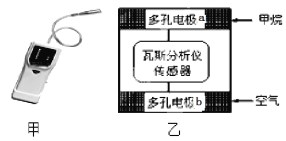
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
难度: 简单查看答案及解析
-
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
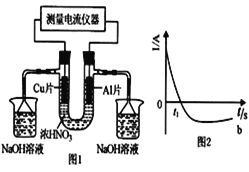
A. t1时刻前,A1片的电极反2A1-6e-+3H2O===A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH-=2NO3-+H2O
难度: 困难查看答案及解析
-
镍(Ni)镉(Cd)可充电的电池,放电时,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是:Cd+2OH--2e-=Cd(OH)2 ;2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-。下列说法不正确的是
A.电池放电时,负极周围溶液的pH不断减小
B.电池放电时总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2
C.电池充电时,镉(Cd)元素被氧化
D.电池充电时,电池的正极和电源的正极相连接
难度: 中等查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
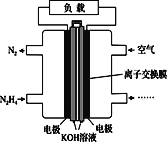
A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,正极发生氧化反应,pH减小
难度: 简单查看答案及解析
-
已知电导率越大导电能力越强。常温下用0.10 mol·L-1NaOH溶液分别滴定10mL浓度均为0.10 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是
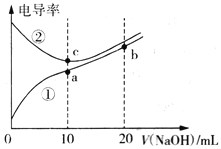
A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
难度: 困难查看答案及解析
-
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
难度: 简单查看答案及解析
-
已知t ℃时AgCl的Ksp=2×10-10;在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
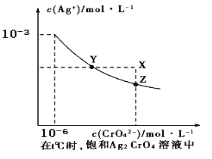
A. 在t ℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t ℃时,AgCl的溶解度大于Ag2CrO4
难度: 中等查看答案及解析
-
为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )

A. ①浊液中存在平衡:AgSCN(s)⇌Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. 该实验可以证明AgI比AgSCN更难溶
D. ③中颜色变化说明有AgI生成
难度: 简单查看答案及解析