-
下列措施不符合节能减排的是
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安裝太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 简单查看答案及解析
-
下列说法正确的是
A.活化分子碰撞即发生化学反应
B.升高温度会加快反应速率,其主要原因是增加了活化分了碰撞的次数
C.有气体参加的化学反应,增大压强可增大活化分子百分数,从而使反应速率增大
D.活化分子间的碰撞不一定是有效碰撞
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
反应 3NO2(g)+H2O(l)
2HNO3(aq)+NO(g) △H<0。达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.氨气是弱电解质,铜是强电解质
C.氢氧化钠是强电解质,醋酸是弱电解质
D.硫酸钠是强电解质,硫酸钡是弱电解质
难度: 中等查看答案及解析
-
室温下,0.1mol·L-1的硫酸中,水的KW值为
A.大于1×10-14 B.小于1×10-14
C.等于1×10-14 D.无法确定
难度: 简单查看答案及解析
-
甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为
A.10∶1 B.1∶10 C.2∶1 D.1∶2
难度: 中等查看答案及解析
-
己知在1×105Pa、298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2(g)+
O2(g)=H2O(g) △H=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ·mol-1
C.H2O(g)=H2(g)+
O2(g) △H=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1.
难度: 中等查看答案及解析
-
增加压强,下列反应速率不会变大的是
A.碘蒸气和氢气化合成碘化氢 B.稀硫酸和氢氧化钠溶液反应
C.二氧化碳通入澄清石灰水中 D.氨的催化氧化
难度: 中等查看答案及解析
-
在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是
A.1×10-1mol/L B.1×10-6mol/L C.1×10-3mol/L D.1×10-13mol/L
难度: 中等查看答案及解析
-
反应4A(g)+5B(g)
4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A.A的平均反应速率是0.010mol·L-1·s-1
B.容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比—定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.3mol
难度: 中等查看答案及解析
-
已知热化学方程式:则下列说法正确的是
①CO(g)+
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
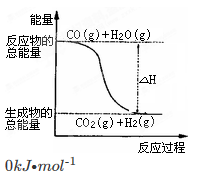
A.H2的燃烧热为241.8kJ·mol -1
B.由反应①、②可知如图所示的热化学方程式为 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol -1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol -1
难度: 中等查看答案及解析
-
向少量FeCl3溶液中滴入KSCN溶液,发生反应:FeCl3+3KSCN
Fe(SCN)3+3KCl。欲使试管内溶液红色变浅,下列措施合理的是
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体
A.①② B.②③ C.②④ D.①④
难度: 中等查看答案及解析
-
足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的
A.水 B.NaOH固体 C.Na2CO3固体 D.NaNO3溶液
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡的是H2O
H++OH-向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
难度: 中等查看答案及解析
-
下列说法正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
D.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
难度: 中等查看答案及解析
-
在某容器中,C+H2O(g)
CO(g)+H2(g),反应达到平衡时,在温度、体积不变的情况下,向容器中充入一定量H2,当建立新平衡时
A.CO、H2的浓度都比原平衡时小
B.CO、H2的浓度都比原平衡时大
C.H2 (g)、H2 O的浓度都比原平衡时大
D.CO、H2O(g)的浓度都比原平衡时大
难度: 中等查看答案及解析
-
如图可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
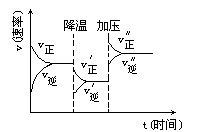
A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体
C.改变物质浓度,平衡不会移动 D.A、B、C、D均为气体
难度: 中等查看答案及解析
-
今有室温下有四种溶液,有关叙述不正确的是( )
①
②
③
④
PH
11
11
3
3
溶液
氨水
NaOH溶液
醋酸
盐酸
A.分别加水稀释10倍,四种溶液的pH①>②>④>③
B.①加入适量的氯化铵晶体后,溶液的pH减小
C.①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9
难度: 困难查看答案及解析
-
在一个体积恒定的密闭容器中,N2与H2反应合成氨的反应达到平衡后,容器中含 1molN2, 3molH2,1molNH3,保持温度不变,向该容器中再加1mol N2, 3mol H2,1molNH3,下列说法正确的是
A、正、逆反应速率同时增大,平衡不移动
B、正、逆反应速率同时增大,NH3百分含量增大
C、正.逆反应速率不变,平衡不移动
D、正反应速率增大,逆反应速率减小,平衡向逆反应移动
难度: 中等查看答案及解析