-
下列变化的熵变大于零的是( )
A.H2O(l)→H2O(g) B.CO2(g)→CO2(s)
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O D.NH3(g)+HCl(g)=NH4Cl(s)
难度: 中等查看答案及解析
-
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是
A. K+、Ba2+、Cl–、NO3– B. Na+、Ca2+、I–、NO3–
C. NH4+、Al3+、Br–、SO42– D. K+、Na+、HCO3–、SO42–
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
①伴有能量变化的物质变化都是化学变化 ②物质发生化学反应都伴随能量变化
③所有的氧化还原反应都是放热反应 ④所有的燃烧反应都是放热反应
⑤需要加热才能发生的的反应一定是吸热反应 ⑥放热反应在常温下均很容易进行
A. ①②④⑤ B. ②④ C. ②③④ D. 全部
难度: 中等查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是:( )
A. c(NH4+)=c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(OH-)+c(SO42-) = c(NH4+)+c(H+)
难度: 简单查看答案及解析
-
对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是( )

难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B. 相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2∶1
C. 已知2SO2(g)+ O2(g)
2SO3 (g)△H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
难度: 中等查看答案及解析
-
在一定条件下,发生CO(g)+NO2(g)
CO2(g)+NO(g)ΔH<0的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
A. 变深 B. 变浅 C. 不变 D. 无法判断
难度: 中等查看答案及解析
-
实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l ,0.1 mol/L某一元碱(BOH)溶液里:c(H+)/c(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是 ( )
A. c(B+)> c(A-)> c(OH-)> c(H+)
B. c(A-)> c(B+)> c(H+)> c(OH-)
C. c(H+)> c(A-)>c(OH-)>c(B+)
D. c(B+)>c(A-)> c(H+)> c(OH-)
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,电池反应如下:PbO2+Pb+2H2SO4
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
A.电池放电时,PbO2是负极;充电时,PbO2是电池的阳极
B.负极的电极反应式为:Pb+SO42﹣﹣2e﹣=PbSO4
C.放电时,PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
反应2X(气)+Y(气)=2Z(气)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是
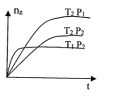
A. T1<T2 P1<P2 B. T1<T2 Pl>P2
C. T1>T2 P1>P2 D. T1>T2 P1<P2
难度: 中等查看答案及解析
-
下列关于化学平衡常数的说法中,正确的是( )
A. 在任何条件下,化学平衡常数K都是一个定值
B. 当改变反应物的浓度时,化学平衡常数会发生改变
C. 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关
D. 化学平衡常数K与反应物的转化率是一一对应的
难度: 简单查看答案及解析
-
下列离子方程式中,属于电离反应的是( )
A. CO2+H2O
HCO3— + H+ B. HCOOH+H2O
HCOO— + H3O+
C. CO32— + H2O
HCO3— + OH— D. HS— + H2O
H2S + OH-
难度: 中等查看答案及解析
-
常温下,将甲酸(HCOOH)和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中( )
A. c(HCOO-) >c(Na+) B. c(HCOO-) <c( Na+)
C. c(HCOO-) =c(Na+) D. 无法确定c(HCOO-) 与c(Na+) 的关系
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g) + Y(g)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表:
t /min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A. 反应前2min的平均速率v(Z) =4.0×10-3mol/(L•min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆) > v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
已知反应2A(g)+B(g) =C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A. ΔH<0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS>0 D. ΔH>0,ΔS<0
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. Na与水反应时增大水的用量
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g)达到平衡状态的标志是 ( )
A. 单位时间内生成nmolA2,同时消耗2 n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
难度: 中等查看答案及解析
-
将2 molX和2molY充入2L密闭容器中发生如下反应:
X(气)+3Y(气)2Z(气)+aQ(气)
2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
A.a的值为2 B.平衡时X的浓度为0.2mol/L
C.Y的转化率为60% D.反应速率v(Y)=0.3mol/(L·min)难度: 中等查看答案及解析
-
在可逆反应中,改变下列条件一定能加快反应速率的是( )
A. 增大反应物的量 B. 升高温度 C. 增大压强 D. 使用催化剂
难度: 简单查看答案及解析

