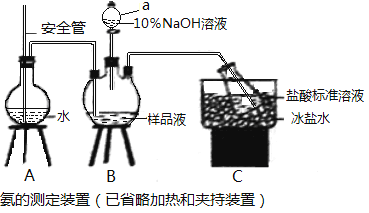
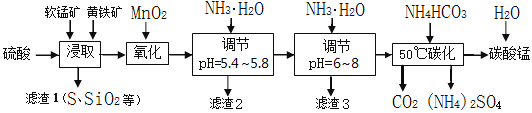
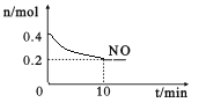
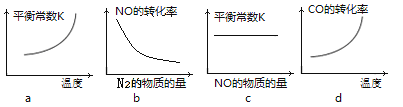
-
下列有关物质性质与用途具有对应关系的是( )
A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 中等查看答案及解析
-
化学与生产、生活、环境等社会实际密切相关。下列相关叙述正确的是
A. 燃煤中加入CaO主要是为了减少温室气体的排放
B. 75%酒精消毒原理和“84”消毒液(主要成分NaClO)消毒的原理相同
C. 纳米铁粉通过物理吸附去除污水中Hg2+、Pb2+等重金属离子
D. 汽车尾气中含有的氮氧化物,会加剧酸雨的形成
难度: 中等查看答案及解析
-
《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,下列有关说法正确的是
A. 黑火药属于纯净物
B. 黑火药爆炸时,KNO3作还原剂
C. 利用焰色反应区分硝石(KNO3)和朴硝(Na2SO4)
D. 硫磺只能作氧化剂
难度: 中等查看答案及解析
-
下列说法正确的是
A. 电解饱和食盐水可以直接制取“84”消毒液
B. 溶液导电过程就是电解过程,溶液的pH肯定会发生变化
C. 共价化合物中一定没有离子键,离子化合物中一定没有共价键
D. 焓减小,熵增加的反应,一定不能自发进行
难度: 中等查看答案及解析
-
下列说法正确的是
A. 淀粉和纤维素互为同分异构体 B. 植物油氢化过程中发生了加成反应
C. 环己烷与苯可用酸性KMnO4溶液鉴别 D. 水可以用来分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 2−甲基丁烷也称异丁烷 B. 由乙醇生成乙醛属于加成反应
C. C4H9Cl有4种同分异构体 D. 油脂和蛋白质都属于高分子化合物
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,A在地壳中含量最高,D所在族序数是周期数的2倍,B、C、D的最外层电子数之和为10。下列说法正确的是
A. 简单离子半径:B>C>D>A
B. B、C、D的最高价氧化物对应的水化物均能两两反应
C. A和D组成的化合物在熔融状态下可以导电
D. 简单气态氢化物的稳定性: D>A
难度: 中等查看答案及解析
-
下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A. 氢硫酸的还原性强于亚硫酸
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. 0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4和1.5
D. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 使用催化剂能够降低化学反应的反应热(△H)
B. 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C. 原电池中发生的反应达平衡时,该电池仍有电流产生
D. 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
难度: 简单查看答案及解析
-
下列生活用品中主要由合成纤维制造的是( )
A. 尼龙绳 B. 宣纸 C. 羊绒衫 D. 棉衬衣
难度: 中等查看答案及解析
-
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是
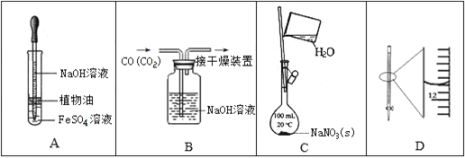
A. 观察Fe(OH)2的生成
B. 除去CO中的CO2
C. 配制一定物质的量浓度的NaNO3溶液
D. 25 mL滴定管读数为11.80 mL
难度: 中等查看答案及解析
-
下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
难度: 困难查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使甲基橙变黄色的溶液中:Na+、Al3+、SO42−、Cl−
B. pH=7的溶液中:K+、Na+、AlO2−、CO32−
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3−、SO42−
D.
=1×10−13 mol•L−1的溶液中:NH4+、Ca2+、Cl−、NO3−
难度: 困难查看答案及解析
-
古丝绸之路贸易中的下列商品,主要成分属于无机物的是


A.瓷器
B.丝绸
C.茶叶
D.中草药
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是
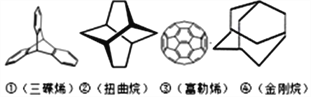
A. ①④互为同分异构体 B. ①③均能发生加成反应
C. ①②③④均属于烃 D. ①②③④的一氯代物均只有1种
难度: 中等查看答案及解析
-
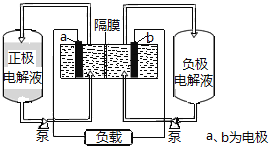
中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。
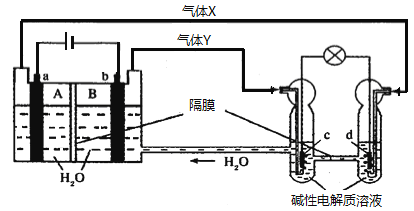
下列说法正确的是
A. B区的OH−通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e−
H2↑
C. 图中右管中的OH−通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
难度: 困难查看答案及解析
-
中国科学院成功开发出一种新型铝−石墨双离子电池,大幅提升了电池的能量密度。该电池放电时的总反应为: AlLi+CxPF6
Al+xC+Li++PF6−,有关该电池说法正确的是
A. 充电时,PF6−向阳极移动
B. 充电时,铝电极质量减少
C. 放电时,正极反应式为:Al+Li++e−
AlLi
D. 放电时,电子由石墨沿导线流向铝
难度: 中等查看答案及解析
-
往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32−(aq)+CaSO4(s)
CaCO3(s)+SO42−(aq)
难度: 中等查看答案及解析
-
下列指定反应的离子方程式不正确的是
A. 钠与水反应:2Na+2H2O
2Na++2OH–+H2↑
B. 向碳酸氢铵溶液中加入足量石灰水: Ca2++HCO3−+OH–
CaCO3↓+H2O
C. 向氢氧化钡溶液中加入稀硫酸: Ba2++2OH −+2H++SO42−
BaSO4↓+2H2O
D. 泡沫灭火器反应原理:3HCO3−+Al3+
3CO2↑+Al(OH)3↓
难度: 困难查看答案及解析
-
用0.1 mol·L−1的盐酸滴定20 mL约0.1 mol·L−1氨水,滴定曲线如图所示,下列说法正确的是
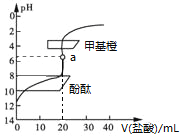
A. a点溶液中:c(H+)=c(OH−)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH−)+c(Cl−)
难度: 困难查看答案及解析
-
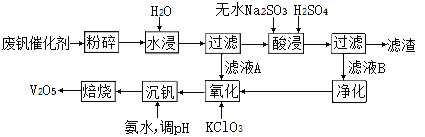
在湿法炼锌的电解循环溶液中,较高浓度的
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
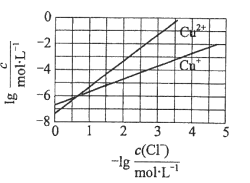
A.
的数量级为
B. 除
反应为Cu+Cu2++2
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
难度: 困难查看答案及解析