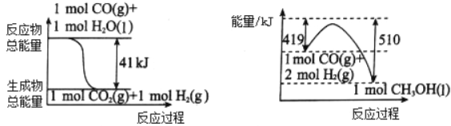
-
下列实验中所用的试剂、仪器或用品(夹持装置、活塞省去)能够达到该目的的是
选项
目的
试剂
仪器或用品
A
验证牺牲阳极的阴极保护
酸化NaCl 溶液、Zn 电极、Fe 电极、铁氰化钾
烧杯、电压表、导线、胶头滴管
B
铝热反应
氧化铁、铝粉
滤纸、酒精灯、木条、盛沙子的蒸发皿
C
配制1.000 mol/L NaCl
NaCl
容量瓶、烧杯、玻璃棒、试剂瓶
D
制备乙酸乙酯
乙醇、乙酸、饱和碳酸钠
大小试管、酒精灯
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列离子反应方程式正确的是
A. 向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
B. 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2+ +2OH- =CaCO3↓+2H2O+MgCO3↓
C. 往FeCl3溶液中通入H2S气体:2Fe3+ + H2S = 2Fe2++ S↓+ 2H+
D. 大苏打溶液中加入稀硫酸:S2O32—+2SO42—+6H+ =4 SO2↑+3H2O
难度: 困难查看答案及解析
-
下列有关实验,对应现象以及结论都正确的是:
选项
实验
现象
结论
A
向硫酸铜溶液中通入足量CO2
有蓝色沉淀生成
因发生双水解反应生成CuCO3沉淀
B
向氯水中滴加少量石蕊试液
溶液先变红后褪色
氯水具有酸性和漂白性
C
将铜粉放入稀硫酸溶液中并不断通入O2,再在溶液中滴加少量FeSO4溶液
铜粉快速溶解,溶液变为蓝色
形成Fe—Cu原电池反应,加快反应速率
D
向稀硝酸中加入过量Fe粉,反应完全再在溶液中滴加KSCN溶液
溶液变为血红色
Fe与硝酸反应得到Fe3+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1 , 则该溶液中溶质的pc=5。下列说法正确的是
A. 电解质溶液的pc(H+)与pc(OH﹣)之和均为14
B. 用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大
C. BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小
D. 某温度下Ksp(AgCl)=1.0×10﹣10 ,则其饱和溶液中pc(Ag+)+ pc(Cl﹣)=10
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 分子总数为NA的CO、C2H4混合气体其体积约为22.4L,质量为28g
B. 将1molCl2 通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 2.3克金属钠完全燃烧,转移的电子数为0.1NA
D. 密闭容器中1molH2(g)与1molI2(g)反应制备HI(g),生成2NA个H-I键
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X 与Y、Z、W不在同一周期,Y最外层电子数是次外层电子数的3倍,W与Y同主族,Z是地壳中含量最多的金属元素。下列说法正确的是( )
A. Y的单质的氧化性比W的弱
B. 原子半径:r(X)< r(Y)< r(W)< r(Z)
C. 化合物X2Y和Z2Y3,含有相同类型的化学键
D. 元素Y、Z形成的化合物熔点高,不能用电解法制备其中的金属单质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 78g Na2O2 固体中含有的离子数之和为3NA
B. 标准状况下22.4LCl2 通入足量水中,反应中转移的电子数为NA
C. 18 g D2O所含有的质子数、电子数均为10NA
D. pH =1的醋酸溶液中含有的H+数目为0.1NA
难度: 中等查看答案及解析
-
某有机物的结构如下图所示,下列关于该有机物的说法正确的是
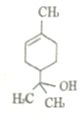
A. 该有机物催化加氢后的分子式为C10H18O
B. 分子中环上的碳原子可能在同一平面内部
C. 1mol该有机物能与1mol NaOH反应
D. 该有机物中碳原子上的氢原子的一氯代物的同分异构体有7 种( 不考虑立体异构)
难度: 中等查看答案及解析
-
钠电池由于其快速充放电的特性受到科研工作者的重视,某钠离子钛基电池电池结构如图所示,电解质为含钠离子的高聚物,已知电池的反应方程式为2NaxCn+xNaTi2(PO4)3
2nC+ xNa3Ti2(PO4)3。 下列关于该电池说法正确的是

A. 放电时电池正极为NaxCn B. 放电时Na+向电极Ⅱ移动
C. 充电时阳极反应:NaxCn-xe-=nC+xNa+ D. 充电时电极Ⅰ与外电源正极相连
难度: 困难查看答案及解析
-
类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
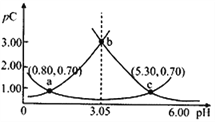
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,
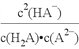 =104.50
=104.50D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
难度: 困难查看答案及解析
-
如图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
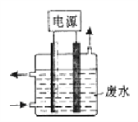
A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-= ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ = N2↑+2CO2↑+5Cl-+H2O
难度: 困难查看答案及解析
-
以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是
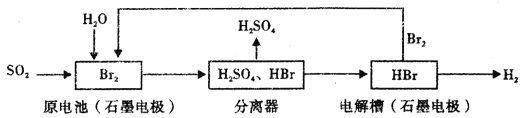
A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
难度: 中等查看答案及解析
-
下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,
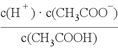 减小
减小D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
难度: 困难查看答案及解析
-
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。研究发现,青铜器在潮湿环境中发生电化学腐蚀的原理示意图如下,下列说法正确的是
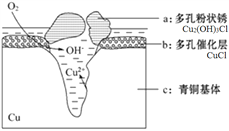
A. 腐蚀过程中,青铜基体是正极
B. CuCl在腐蚀过程中降低了反应的焓变
C. 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.448L
D. 将糊状Ag2O涂在被腐蚀部位,可以防止青铜器进一步被腐蚀,Ag2O与催化层发生复分解反应
难度: 困难查看答案及解析
-
有四种短周期主族元素z、e、g、h,其最高价氧化物对应水化物溶液(浓度均为0.01molL﹣1)的pH与原子序数的关系如图所示。下列说法正确的是
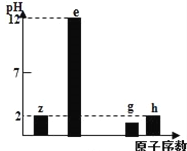
A. 离子半径大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有离子键有含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值 h >g> z
难度: 中等查看答案及解析
-
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。下列说法错误的是

A. ②的作用是安全瓶
B. ③中试剂更换为Ba(NO3)2后,无明显现象发生
C. ④中的现象说明SO2具有氧化性
D. ⑤用于检验SO2的漂白性
难度: 中等查看答案及解析
-
在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n) 的取值范围是
A. n≥1 B. 1 C. 2≤n<4 D. n≥4
难度: 困难查看答案及解析
-
下列各组离子,在指定的条件下一定能大量共存的是
A. c(S2-)= 0.1 mol•L-1的溶液中:Na+、NH4+、ClO-、SO42-
B. 含有大量HCO3-:的溶液:NH4+、Ca2+、A1O2-、I-
C. 浓度为3%的H2O2溶液:H+、Fe2+、C1-、SO42-
D. NH4Fe(SO4)2 的溶液中:H+、Mg2+、Br-、NO3-
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。元素W与Z形成的化合物具有还原性,且其水溶液显弱酸性。W所在周期数和族序数相同,且W与Y 同族、X 与Z同族。下列叙述正确的是
A. 最简单气态氢化物的稳定性:X<Z
B. X、Y、Z三种元素共同组成的盐只有2种
C. X 与Y 形成的化合物中,阴阳离子的数目比为1: 2
D. Y与Z的简单离子具有相同的电子层结构
难度: 中等查看答案及解析