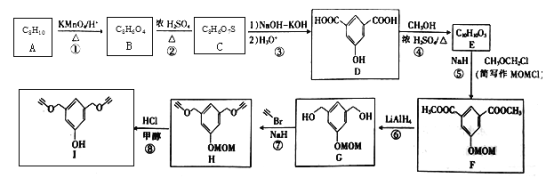
-
化学与生产、生活密切相关,下列说法错误的是
A. 用K2FeO4处理自来水,既可杀菌消毒又可除去悬浮杂质
B. NH4MgPO4·6H2O(鸟粪石)与草木灰混合施肥效果更好
C. 将地沟油回收加工为生物柴油,既可获得能源物质又可防止水体污染
D. 医院常用含碘2%~3%的酒精溶液用作医疗消毒剂,因为它能使蛋白质变性
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 28g乙烯与28g丙烯含氢原子数均为4NA
B. 标准状况下,22.4L氦气与11.2LH2含有的质子数均为NA
C. 0.1 mol CH4与0.1 mol Cl2充分反应,生成C-Cl和H-Cl键数均为0.2NA
D. 25℃时,1LpH=11的NaOH溶液与1LpH=11的CH3COONa溶液,含阴离子数均为10-11NA
难度: 中等查看答案及解析
-
1,4-二氧杂螺[2.2]丙烷的结构简式为
,有关该有机物的说法正确的是
A. 三个碳原子位于同一直线
B. 二氯代物有2种
C. 所有原子位于同一平面
D. 与其互为同分异构体的化合物有2种
难度: 困难查看答案及解析
-
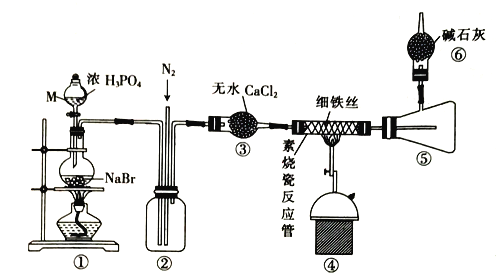
实验室可用下图装置制取少量氮气。下列说法正确的是
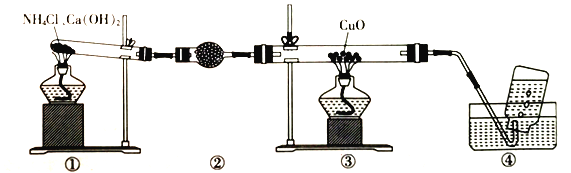
A. ②中盛放的是五氧化二磷
B. 实验开始时先点燃③的酒精灯,再点燃①的酒精灯
C. ③中玻璃管中的反应:2NH3+3CuO
N2+3Cu+3H2O
D. 实验结束时先熄灭①、③的酒精灯,再将导管从水槽中拿出
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,它们的最外层电子数之和为22。W、Y同主族,X所处的周期数等于族序数,常温下Y的最高价氧化物对应的水化物可贮存在由X的单质制成的容器中。下列说法错误的是
A. 简单离子半径:X>Y>Z
B. X、Z两种元素形成的化合物的水溶液呈酸性
C. W的一种氢化物与Y的氢化物在水溶液中可反应生成Y的单质
D. W、Y两种元素形成的一种化合物能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
电导滴定是利用溶液的电导改变以确定滴定终点的滴定方法。常温下,将0.10mol·L-1CH2COOH溶液与0.10mo1·L-1HCl溶液以一定体积比混合,用0.10mol·L-1NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是
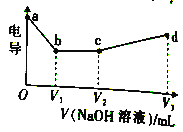
A. a点溶液的pH=1
B. b点溶液中:c(Na+)=c(Clˉ)+c(CH3COOˉ)
C. 图中四点,C点处溶液中水的电离度最大
D. d点溶液中:c(Na+)>c(Clˉ)>c(CH3COOˉ)>c(OHˉ)>c(H+)
难度: 困难查看答案及解析
-
Kolbe法制取乙烯的装置如图所示,电极a上的产物为乙烯和碳酸根离子。下列说法正确的是( )
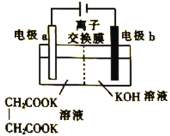
A. 该装置将化学能转化为电能
B. 图中为阳离子交换膜
C. 阴极周围溶液的pH不断减小
D. 每生成1mol乙烯,电路中转移2mol电子
难度: 中等查看答案及解析