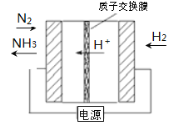
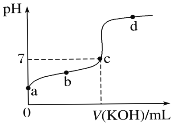
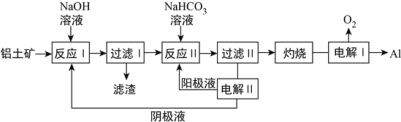
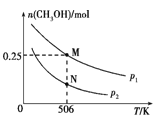
-
下列说法不正确的是
A. pH<7的溶液不一定呈酸性
B. 在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
C. 在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-)
D. 氨水和盐酸反应后的溶液,若c(Cl―)=c(NH4+),则溶液呈中性
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中K+、Na+、MnO4-、SO42- ②pH=1的溶液CO32 -、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中Cl-、HCO3-、SO42-、NH4+
④由水电离的C(OH-)= 10-13 mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中Fe3+、Al3+、NO3-、I-、Cl-
A. ④ B. ③⑥ C. ①② D. ③⑤
难度: 中等查看答案及解析
-
下列说法不正确的是
A. MCl2在水溶液中的电离方程式为:MCl2=M2++2Cl—,则M(OH)2可能是弱电解质
B. 足量的锌分别与等体积的盐酸(pH=1)和醋酸(0.1moL/L)反应,在相同条件下产生的氢气体积相同
C. NaHSO3溶液显酸性的原因是HSO3—的电离强于水解
D. pH相同的氨水和氢氧化钠加水稀释相同倍数后,c(NH4+)=c(Na+)
难度: 中等查看答案及解析
-
TiO2是制取航天工业材料——钛合金的重要原料。为测定纯度,称取上述TiO2试样0.2g,一定条件下将TiO2溶解并还原为Ti3+,得到待测液约30mL,再用0.1 mol·L-1NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+(假设杂质不参与以上反应)。下列说法中错误的是( )
A. 欲配制0.1 mol·L-1NH4Fe(SO4)2标准溶液400mL,需要NH4Fe(SO4)2固体质量13.3g
B. 再进行滴定之前,应向锥形瓶中的待测样品滴加几滴KSCN溶液做指示剂
C. 滴定前仰视读数,滴定结束后俯视读数,将导致测定结果偏大
D. 在其他滴定实验操作均正确时,消耗标准液20.00mL,则样品的纯度为80%
难度: 困难查看答案及解析
-
《本草纲目》中“石碱”一条记载:石碱出山东济宁诸处,彼人采篙寥之属,晒干烧灰,以水淋汁,久则凝淀如石,洗衣发面,亦去垢发面。这里的“石碱”是指
A. KOH B. KAl (SO4)2 C. KHCO3 D. K2CO3
难度: 中等查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
NH4++OH−
B. 由Na和C1形成离子键的过程:

C. 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
D. 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32-
难度: 简单查看答案及解析
-
常温下,下列有关叙述正确的是
A. pH=8的NaY溶液中,c(Na+)-c(Y-)=9.9×10-7mol·L-1
B. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
D. 10 mL pH=12的NaOH溶液中加入pH=2的HA溶液至pH=7,则所得溶液体积一定为20 mL(忽略溶液混合时体积变化)
难度: 中等查看答案及解析
-
某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0,一段时间后,达到化学平衡状态.下列叙述正确的是
A. 通入稀有气体,平衡向正反应方向移动
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 降低温度,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
部分弱电解质的电离常数如下表:
弱电解质
HCOOH
HCN
H2CO3
电离常数(25 ℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7 Ka2=5.6×10-11
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-
HCN+ HCOO-的化学平衡常数3.67×105
难度: 困难查看答案及解析
-
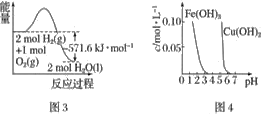
根据下列各图曲线表征的信息,得出的结论不正确的是
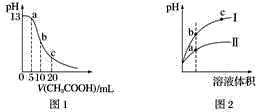
A. 图1表示常温下向体积为10 mL 0.1 mol·L−1NaOH溶液中逐滴加入0.1 mol·L−1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH−)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol−1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
难度: 困难查看答案及解析
-
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2
2SO3,状态Ⅱ时达平衡,则O2的转化率为( )

A. 40% B. 60% C. 80% D. 90%
难度: 简单查看答案及解析
-
T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min
n(CO)/mol
n(H2O)/mol
0
2.00
3.00
t1
0.80
t2
1.80
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 在Na2S溶液中加入少量的Na2S固体,Na2S的水解程度减小
B. 反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,说明该反应的ΔH>0
C. 用碱式滴定管量取20.00mL酸性高锰酸钾溶液
D. 室温下,pH分别为2和4的盐酸等体积混合后,溶液pH=3
难度: 简单查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3溶液中存在:C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. 常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=3.6×10-10
D. 若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),则c(X-)+c(OH-)<c(Y-)+c(OH-)
难度: 中等查看答案及解析
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
难度: 中等查看答案及解析
-
根据下列图示所得出的结论不正确的是
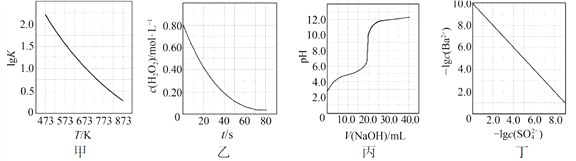
A. 图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
有4种混合溶液,分别由等体积0.1 mol/L的两种溶液混合而成:①NH4Cl与CH3COONa②NH4Cl与HCl③NH4Cl与NaCl④NH4Cl与NH3·H2O(混合液呈碱性)下列各项排序正确的是( )
A. pH:②<①<③<④ B. c(NH4+):①<③<②<④
C. 溶液中c(H+):①<③<②<④ D. c(NH3·H2O):①<③<④<②
难度: 中等查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 简单查看答案及解析
-
25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
难度: 困难查看答案及解析