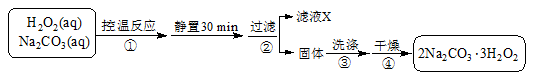
-
下列属于直接利用太阳能辐射能的方式是
①光—热转换 ②光—电转换 ③光—化学能转换 ④光—生物质能转换
A.①②③ B.①③④ C.①②④ D.①②③④
难度: 简单查看答案及解析
-
某物质熔融状态可导电,固态可导电,将其投入水中溶液也可导电,推测该物质可能是
A.金属 B.非金属 C、可溶性碱 D、可溶性盐
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 简单查看答案及解析
-
下列有关物质分类会归类正确的一组是
①液氨、液氯、干冰、碘化银均为化合物
②漂白粉、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质
④Na2O2、Na2CO3、Na2SiO3均为钠盐
A.①② B.②③ C.③④ D.①④
难度: 中等查看答案及解析
-
下列关于胶体的说法不正确的是
A.可用渗析法提纯胶体
B.某纳米材料的粒子直径大小在1~100nm间,该材料属于胶体
C.胶体微粒能透过滤纸
D.往25mL沸水中逐滴加入2mLFeCl3饱和溶液,继续煮沸可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
对于某些物质或离子的检验及结论一定正确的是
A.某物质的水溶液使红色石蕊试纸变蓝,该物质一定是碱
B.某气体能使湿润淀粉碘化钾试纸变蓝,该气体一定是氯气
C.某物质的水溶液中加入盐酸产生无色无味气体,该溶液一定含有碳酸根离子
D.往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色,则该反应后的溶液中肯定有Fe3+,可能还有Fe2+
难度: 中等查看答案及解析
-
下列变化必须加入氧化剂才能实现的是
A.Cr2O72-→CrO42- B.HNO3 →NO2
C.SiO2 →Si D.CH3CH2OH→CH3CHO
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶
C.在标准状况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
难度: 中等查看答案及解析
-
对实验I~Ⅳ的实验现象预测正确的是

A.实验I:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色仍无色
D.实验Ⅳ:放一段时间后,饱和CuSO4溶液中出现蓝色晶体
难度: 中等查看答案及解析
-
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸;
②用酒精洗涤粘有硫粉的试管;
③用托盘天平称量10.1 g氯化钠晶体;
④用饱和NaHCO3溶液除去CO2中的少量SO2;
⑤用瓷坩埚熔融NaOH固体;
⑥实验中不慎将手指划破,可立即用FeCl3溶液止血
A.①②③④ B.③④⑥ C.③④⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
向某烧碱溶液中通入5.28gCO2后,将溶液在低温下蒸干,得到固体物质的质量为17.32g,则该固体物质是
A .Na2CO3 B.NaHCO3 C.Na2CO3和NaOH D.Na2CO3和NaHCO3
难度: 中等查看答案及解析
-
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是
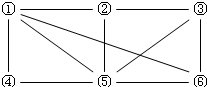
A.Al或Fe2O3 B.NaOH溶液
C.氢碘酸 D.NH3或O2
难度: 困难查看答案及解析
-
某无色透明溶液含有下列离子中的几种:Mg2+、Cu2+、Ba2+、H+、SO42-、OH-、NO3-、HCO3-,在其中加入金属铁,发生反应放出气体只有H2。根据上述描述判断上述离子中一定不能大量存在于此溶液中的有
A.3种 B.4种 C.5种 D.6种
难度: 困难查看答案及解析
-
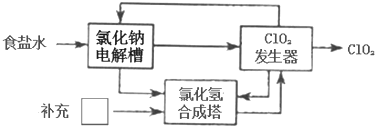
根据下图海水综合应用的工业流程图,判断下列说法正确的是
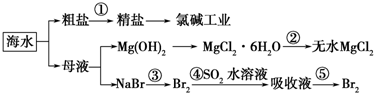
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩富集溴
难度: 困难查看答案及解析
-
某可逆反应的△H=+146kJ/mol,下列关于该反应的叙述正确的是
A.正反应的活化能比逆反应的活化能大146kJ/mol
B.正反应的活化能一定小于146kJ/mol
C.逆反应的活化能一定大于146kJ/mol
D.逆反应的活化能一定大于正反应的活化能
难度: 简单查看答案及解析
-
在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol/L的NaOH溶液中充分反应,放出xkJ热量。已知该条件下,1mol CO2通入到2L1.0mol/LNaOH溶液中充分反应,放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确为
A.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ/mol
B.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ/mol
C.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y)kJ/mol
D.CO2(g)+NaOH(aq)=2NaHCO3(aq)△H=-(8x-2y)kJ/mol
难度: 困难查看答案及解析