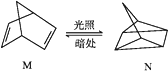
-
化学与生活息息相关,下列有关说法正确的是
A. 酱油中加入氯化铁可以治疗缺铁性贫血
B. 融雪工业盐大多含有NaCl,因此可替代食盐食用
C. 食用油的主要成份是油脂,其成分与汽油、煤油相同
D. 《本草拾遗》记载“醋……消食,杀恶毒……”其中醋的有效成分是乙酸
难度: 中等查看答案及解析
-
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(H2)=0.3 mol·L-1·min-1 B. v(N2)=0.05 mol·L-1·s-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列事实不能用元素周期律解释的是
A. 碱性:NaOH > Mg(OH)2
B. 酸性:H2SO4 > HClO
C. 稳定性:HBr > HI
D. 氧化性:O2 > S
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是
A. Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ/mol,反应物总能量<生成物总能量
B. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C. 101 kPa时,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,H2的燃烧热ΔH=-241.8 kJ/mol
D. H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
难度: 中等查看答案及解析
-
下列有关化学现象和化学概念表述正确的是
A. 由于四氯化碳的沸点高,所以四氯化碳可用于灭火
B. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C. 鉴定FeCl3溶液中含有FeCl2可以滴加酸性KMnO4溶液,若褪色,则证明有FeCl2
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 淀粉、纤维素和油脂都属于天然高分子化合物
B. 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解
C. 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少
D. 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 22.4 L(标准状况)N2O4含有的原子数为6NA
C. 1.0 mol羟基含有电子数为9.0NA
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
难度: 中等查看答案及解析
-
已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(III)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+=4Cr3++7O2+6H2O)。下列有关说法正确的是( )
A. CrO5中Cr元素的化合价为+10
B. 过氧化铬中含有极性共价键、非极性共价键和离子键
C. 过氧化铬具有较强的氧化性
D. 上述反应每转移0.2mol电子就能生成2.24LO2
难度: 中等查看答案及解析
-
下列实验中,对应的现象及结论都正确的是
选项
实验
现象
结论
A
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
证明该溶液一定为钠盐溶液
B
用浓盐酸和石灰石反应产生的气体直接通入Na2SiO3溶液中
Na2SiO3溶液变浑浊
C元素的非金属性大于Si元素
C
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
向某溶液中加入稀硝酸酸化的BaCl2 溶液
产生白色沉淀
该溶液中一定存在SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是
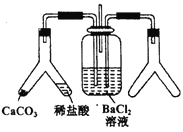
A. Cu和浓硝酸 B. CaO和浓氮水 C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
难度: 中等查看答案及解析
-
利用海洋资源获得的部分物质如图所示.下列说法正确的是
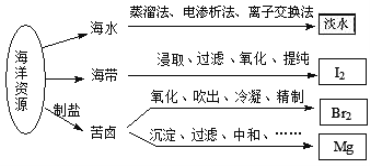
A. 从海水中获取淡水,历史最久的方法是离子交换法
B. 实验室中从海带中获得I2,需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等
C. 用Na2CO3溶液吸收从苦卤中吹出的单质溴时,发生的化学反应可以是3Br2+3Na2CO3═5NaBr+ NaBrO3+3CO2或3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3
D. 用贝壳、盐酸等从苦卤中提取镁时,发生反应的类型有化合、分解、置换和复分解
难度: 中等查看答案及解析
-
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是
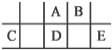
A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. 简单离子的半径由大到小为:E>A>B>C
D. D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构
难度: 中等查看答案及解析
-
现有MgSO4和AlCl3混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )

A. 1:6
B. 1:3
C. 6:1
D. 3:1
难度: 中等查看答案及解析
-
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右上图所示,其中A、B为多孔导电材料。下列说法一定正确的是
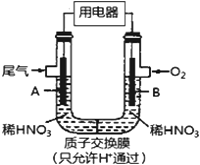
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ ,NO-3e-+2H2O=NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标况),可以除去含1molNO和NO2的混合尾气
难度: 简单查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(
)是最简单的一种。下列关于该化合物的说法正确的是( )
A. 与环戊烯不是同分异构体 B. 二氯代物是三种
C. 所有碳原子均处同一平面 D. 螺[2,2]戊烷不是饱和烃
难度: 中等查看答案及解析
-
研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是
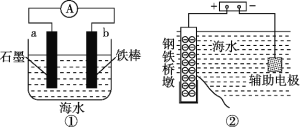
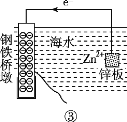
A. 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能与电能相互转化的电解质
难度: 中等查看答案及解析
-
下列关于如图所示转化关系(X代表卤素)的说法错误的是
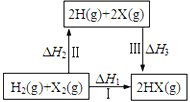
A. ΔH3<0 B. ΔH1=ΔH2+ΔH3
C. 按Cl、Br、I的顺序,ΔH2依次增大 D. ΔH1越小,HX越稳定
难度: 中等查看答案及解析
-
2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰。据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。下列有关说法不正确的是
A. 自然界中没有游离的钠和铝
B. 若铝钠合金投入水中得无色溶液,则n(Al)≤ n(Na)
C. 铝钠合金投入到足量氯化铜溶液中,一定有氢氧化铜沉淀,可能有铜和氧化铜
D. m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多铝的质量分数越小
难度: 简单查看答案及解析