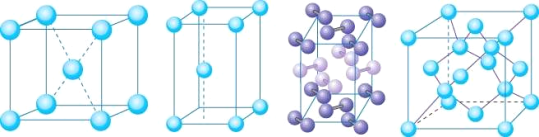
-
有机物种类繁多的主要原因是
A. 自然界中存在着多种形式的大量的有机物
B. 碳原子能与其他原子形成四个共价键,且碳原子之间也能相互成健
C. 有机物除含碳元素外,还含有其他多种元素
D. 有机物的分子结构十分复杂
难度: 中等查看答案及解析
-
下列关于F、Cl、Br、I性质的比较,不正确的是( )
A. 它们的原子核外电子层数随核电荷数的增加而增多
B. 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C. 它们的氢化物的稳定性随核电荷数的增加而增强
D. 单质的颜色随核电荷数的增加而加深
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A. 左下方区域的金属元素
B. 金属元素和非金属元素分界线附近的元素
C. 右上方区域的非金属元素
D. 稀有气体元素
难度: 中等查看答案及解析
-
下列实验中,不能观察到明显变化的是
A. 把一段打磨过的镁带放入少量冷水中
B. 把 Cl2通入FeCl2溶液中
C. 把绿豆大的钾投入水中
D. 把溴水滴加到KI淀粉溶液中
难度: 中等查看答案及解析
-
某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配置该营养液,取428 g NH4Cl,则需KCl和K2SO4的质量分别为( )
A. 53.5 g和214 g B. 74.5 g和348 g
C. 74.5 g和696 g D. 149 g和696 g
难度: 困难查看答案及解析
-
化学与生活密切相关,下列常见物质按酸碱性的一定顺序依次排列正确的是
A. 厕所清洁剂、醋、肥皂、厨房清洁剂 B. 厕所清洁剂、厨房清洁剂、醋、肥皂
C. 醋、厕所清洁剂、肥皂、厨房清洁剂 D. 厨房清洁剂、醋、肥皂、厕所清洁剂
难度: 中等查看答案及解析
-
根据元素周期表,判断下列元素中不属于主族元素的是
A. Sn B. Se C. Sb D. Sc
难度: 简单查看答案及解析
-
下列说法错误的是
A. 石灰法是目前应用最广泛的工业废气脱硫方法,通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可作建筑材料。
B. 四氯化碳,一种有机溶剂,与水互不相溶,密度比水大,曾用做灭火器,但因与水在高温下反应时会生成 有毒物质,现已被禁用
C. 私人汽车与公交车相比,前者的耗油量和排出的污染物均大约是后者的1/5,因此应该大力提倡私人汽车
D. 胶体粒子做布朗运动,与粒子所处体系中的分散剂分子对胶体粒子无休止的随机撞击有关,并不是粒子本身固有的性质。
难度: 中等查看答案及解析
-
下列说法错误的是
A. 氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是‘裸露'的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示
B. 双液原电池盐桥中通常装有含硅胶的KCl饱和溶液,形成闭合回路的同时向负极区输送K+,正极区输送Cl-来保证两极区的电荷守恒
C. 严格的说,Al和NaOH溶液反应生成的化合物为Na[Al(OH)4],写为NaAlO2只是为了表达方便而采用的简写形式
D. 蘸取碳酸钾溶液做焰色反应时要透过蓝色钴玻璃观察,是为了滤去黄光,避免碳酸钾中所含微量钠盐造成干扰
难度: 中等查看答案及解析
-
下列变化中,不属于化学变化的是
A. SO2使品红溶液褪色 B. 氯水使有色布条褪色
C. 活性炭使红墨水褪色 D. 漂白粉使某些染料褪色
难度: 中等查看答案及解析
-
赏心悦目的雕花玻璃是用一种物质对玻璃进行刻蚀而制成的,这种物质是
A. 硫酸 B. 氢氟酸 C. 盐酸 D. 烧碱
难度: 简单查看答案及解析
-
“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。古老的刀耕火种、烧柴做饭、烧炭取暖等粗放方式正在被现代科学技术所改变。下面有关生物质能的说法,不正确的是
A. 利用生物质能就是间接利用太阳能 B. 生物质能是可再生的能源
C. 生物质能是解决农村能源的重要途径 D. 生物质能的缺点是严重污染环境
难度: 中等查看答案及解析
-
下列关于充电电池的叙述,不正确的是
A. 充电电池的化学反应原理是氧化还原反应
B. 充电电池可以无限制地反复放电、充电
C. 充电是使放电时的氧化还原反应逆向进行
D. 较长时间不使用电器时,最好从电器中取出电池,并妥善存放。
难度: 简单查看答案及解析
-
工业上用洗净的废铜屑作原料制备硝酸铜。为节约原料和防止污染,宜采取的方法是
A. Cu+HNO3(浓)→Cu(NO3)2 B. Cu+HNO3(稀)→Cu(NO3)2
C. Cu→CuO→Cu(NO3)2 D. Cu→CuSO4→Cu(NO3)2
难度: 中等查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
难度: 中等查看答案及解析
-
氢气是21世纪极有前途的新型能源,是各国研究的热点之一.氢能开发的首要问题是研究如何以水为原料制取氢气.以下研究方向中你认为可行的是
A. 大量建设水电站,用电力分解水制取氢气
B. 设法将太阳能聚焦,产生高温,使水分解产生氢气
C. 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气
D. 寻找更多的活泼金属,与水发生置换反应,不断从水中制取氢气
难度: 中等查看答案及解析
-
下列反应中,光照对反应几乎没有影响的是( )
A. 氯气与氢气的反应
B. 氯气与甲烷的反应
C. 氧气与甲烷的反应
D. 次氯酸的分解
难度: 中等查看答案及解析
-
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨溶液,在水浴中加热。实验结果没有银镜产生。其原因是
A. 蔗糖尚未水解 B. 煮沸后的溶液中没有加碱,以中和作催化剂的酸
C. 加热时间不够 D. 蔗糖水解的产物中没有葡萄糖
难度: 中等查看答案及解析
-
老鼠能在含饱和多氟碳化物的溶液内部获得氧气,像鱼儿一样在水中游动,另有实验表示,把狗身上的70%的血液,换成由25%的多氟碳化物和75%的水混合成的乳液后仍可存活,科学家预测多氟碳化物可能成为血液的替代品.全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是
A. 全氟丙烷的电子式为
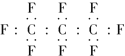 B. 原子半径C比F的小
B. 原子半径C比F的小C. 全氟丙烷分子中的化学键只有共价键 D. 全氟丙烷分子中碳链成直线型
难度: 中等查看答案及解析
-
甲基丙烯酸甲酯——CH2=C(CH3)COOCH3是合成有机玻璃的单体.
旧法合成的反应是:①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:CH3C≡CH+CO+CH3OH→CH2=C(CH3)COOCH3,与旧法相比,新法的突出优点是
A. 原料无爆炸危险 B. 原料都是无毒物质
C. 没有副产物,原料利用率高 D. 对设备腐蚀性较小
难度: 中等查看答案及解析
-
为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中IO3-和I-发生反应:IO3-+5I-+6H+3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是
A. ①③ B. ③⑥ C. ②④⑥ D. ①②④⑤⑦
难度: 中等查看答案及解析
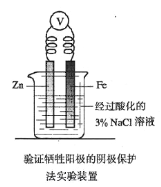
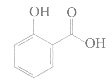 对羟基苯甲酸
对羟基苯甲酸