-
下列包装所贴标识正确的是
选项
A
B
C
D
物质
浓硫酸
酒精
高锰酸钾
氯酸钾
标识


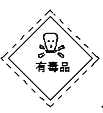

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列科技成果所涉及物质的应用过程中,发生的不是氧化还原反应的是
A. “熬胆矾铁釜,久之亦化为铜”,该过程中发生的反应
B. 偏二甲肼用作发射“天宫二号”的火箭燃料,在发射过程中的反应
C. “青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取过程中的反应
D. 开采可燃冰,将其作为能源使用过程中的反应
难度: 简单查看答案及解析
-
下列物质的分类正确的是
混合物
酸
盐
化合物
A
CuSO4·5H2O
H2SO4
NaCl
盐酸
B
碱石灰
醋酸
生石灰
Na2O
C
KNO3晶体
NH4Cl
Cu2(OH)2CO3
NaOH
D
澄清石灰水
HNO3
NaHSO4
NaHCO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于实验的说法中正确的是
A. 实验桌上的酒精灯倾倒了并燃烧起来,马上用湿布扑灭
B. 蒸馏实验中如果液体较少,可以不加沸石(或碎瓷片)
C. 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D. 选择量筒量取液体时,应满足“大而近”的原则,所以应用10 mL的量简量取8.80 mL稀硫酸
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1 mol Cl2的质量为71 g/mol,1mol Cl-的质量为35.5 g
B. 相同物质的量的固体或液体体积并不相同,其主要原因是粒子的大小不同
C. NH3的摩尔质量是17 g
D. 标准状况下1 mol任何物质体积均约为22.4 L
难度: 简单查看答案及解析
-
下列化学方程式改写成离子方程式不正确的是
A. CuCl2+Ba(OH)2=Cu(OH)2+BaCl2 Cu2++2OH-=Cu(OH)2
B. NH4HCO3+HCl=NH4Cl+CO2+H2O HCO3-+H+=CO2+H2O
C. CH3COOH+NaOH=CH3COONa+H2O H++OH-=H2O
D. 2FeCl3+Cu=2FeCl2+CuCl2 2Fe3++Cu=2Fe2++Cu2+
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A. 1 mol O2含有NA个原子
B. 常温常压下,28 g CO含有分子数为NA
C. 在25℃ 和101 kPa时,22.4 L CO2含的分子数为NA
D. 物质的量浓度为0.2 mol/L AlCl3溶液,含有Cl-的数目为0.6 NA
难度: 中等查看答案及解析
-
从20 mL 0.5 mol/L Na2CO3溶液中取出10 mL,并加水稀释到250 mL,则稀释后溶液中Na2CO3的物质的量浓度为
A. 0.5 mol/L B. 0.2 mol/L C. 0.05 mol/L D. 0.02 mol/L
难度: 简单查看答案及解析
-
下列溶液中,在指定条件下能大量共存的离子组是
A. 无色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2−
B. 遇酚酞试剂变红的溶液:Fe3+ 、K+ 、SO42− 、NO
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42−
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
难度: 中等查看答案及解析
-
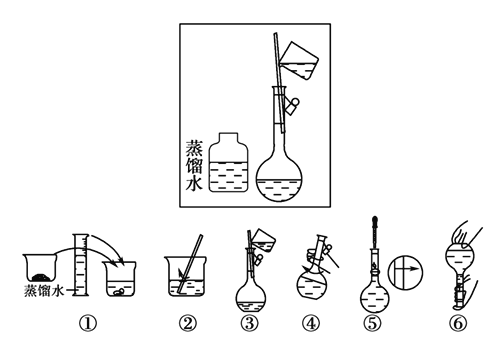
完成下列实验所选择的装置或仪器正确的是( )
选项
A
B
C
D
实验
从食盐水中提取NaCl固体
分离碘和泥沙
分离水和四氯化碳
分离Na2SO4溶液和苯(苯是难溶于水,密度比水小的液体)
装置或仪器
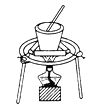
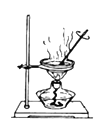
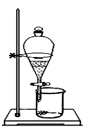
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 清晨的阳光穿过茂密的林木枝叶所产生的美丽光线,这个现象和胶体的性质有关
B. 食品干燥剂发挥作用,可以用氧化还原反应知识解释
C. 仅含有一种元素的物质就是纯净物
D. 电离时产生的阳离子有氢离子(H+)的化合物叫做酸
难度: 简单查看答案及解析
-
将一定量的氯气(分子式为Cl2)通入30 mL浓度为10 mol/L的氢氧化钠浓溶液中,加热少许时间后恰好完全反应,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. Cl2在反应中既作氧化剂又作还原剂
B. NaClO 和NaClO3是还原产物
C. 生成物 n(NaCl) :n(NaClO) :n(NaClO3) 一定为6:1:1
D. 与NaOH反应的氯气一定为3.36 L
难度: 困难查看答案及解析
-
去除下列各物质中的少量杂质,所选用的试剂及操作方法均正确的是
选项
物质(括号内为杂质)
试剂
操作方法
A
Na2SO4 溶液(稀硫酸)
过量的氢氧化钠溶液
用玻璃棒搅拌即可
B
NaCl 固体(CuO固体)
盐酸
溶解、过滤、蒸发结晶
C
Cu(NO3)2溶液(AgNO3 溶液)
足量的铜粉
过滤
D
NH3(H2O)
浓硫酸
洗气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-= N2+3Cl-+2H++3H2O。下列说法中,不正确的是
A. 氧化性ClO- >N2
B. 还原性NH4+< Cl-
C. 反应中氮元素被氧化,氯元素被还原
D. 经此法处理过的废水不可以直接排放
难度: 困难查看答案及解析
-
下列各组溶液中的Cl-的物质的量浓度相等的是
A. 15 mL 0.1 mol/L的MgCl2溶液和15 mL 0.2 mol/L的KClO3溶液
B. 10 mL 0.2 mol/L的NH4Cl溶液和5 mL 0.2 mol/L的FeCl2溶液
C. 5 mL 0.2 mol/L的CaCl2溶液和20 mL 0.1mol/L的KCl溶液
D. 5 mL 0.1 mol/L的AlCl3溶液和15 mL 0.3 mol/L的NaCl溶液
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A. 向NaHSO4溶液中滴加Ba(OH)2溶液至SO42−离子恰好沉淀完全:Ba2++2OH-+2H++SO42−=BaSO4↓+2H2O
B. NaHSO4溶液滴入氢氧化钠溶液:H++OH-=H2O
C. 向澄清石灰水中滴入足量碳酸氢钠溶液:Ca2++ OH-+ HCO3-=CaCO3↓+H2O
D. Ba (OH)2溶液中通入过量CO2:CO2+ Ba2++2OH-=BaCO3↓+ H2O
难度: 困难查看答案及解析
-
已知物质的还原性强弱的顺序为:SO2>I->Fe2+>Cl-,判断下列反应不能发生的是
A. 2Fe3++ SO2 + 2H2O=2Fe2++ SO42−+ 4H+
B. I2 + SO2 + 2H2O=H2SO4 + 2HI
C. 2Fe2++ I2 =2Fe3++ 2 I-
D. 2FeCl2 + Cl2 =2FeCl3
难度: 困难查看答案及解析
-
下列实验操作或叙述正确的是
A. 因为Ba(NO3)2 易溶于水,可将含有Ba(NO3)2 的废液倒入水池中,再用水冲入下水道
B. 检验某溶液中是否含有SO42−时,为防止Ag+、CO32-等离子的干扰,可以先加稀盐酸将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀物
C. 标准状况下,22.4 L NH3溶于910 g水中,得到的溶液密度为0.91 g·cm-3 ,则该溶液的物质的量浓度为 1 mol/L
D. 某无色溶液中加入盐酸生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
难度: 中等查看答案及解析
-
向含有1 mol KI的溶液中加入含0.1 mol X2O72−的酸性溶液,使溶液中I-恰好全部被氧化生成I2,并使X2O72− 被还原为Xn+,则n值为
A. 4 B. 3 C. 2 D. 1
难度: 中等查看答案及解析
-
向100mL 1.2 mol/L溴化亚铁(FeBr2)溶液中通入氯气(标准状况),当有三分之一的溴离子被氧化时,通入的氯气的物质的量为(已知:2Fe2++ Br2 = 2Fe3++ 2 Br-,Cl2 + 2 Br- = Br2 + 2 Cl-)
A. 0.1 mol B. 0.06 mol
C. 0.04 mol D. 0.18 mol
难度: 困难查看答案及解析