-
下列说法正确的是
A. CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计成原电池,把化学能转化为电能
B. 任何化学反应中的能量变化都表现为热量变化
C. 有化学键断裂一定发生化学反应
D. 灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
难度: 困难查看答案及解析
-
根据如下能量关系示意图,下列说法正确的是
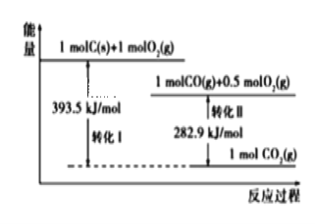
A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= −221.2 kJ∙mol−1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= −10.1 kJ∙mol−1
难度: 困难查看答案及解析
-
固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)
2HI(g) △H1=-9.48kJ·mol-1
② H2(g) +I2(?)
2HI(g) △H2=+26.48kJ·mol-1
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. l mol固态碘升华时将吸热35.96kJ
难度: 困难查看答案及解析
-
一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g)
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
难度: 困难查看答案及解析
-
向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g)
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
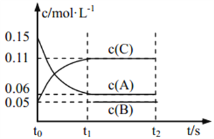
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡,A的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段,此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)
B(g)+2C(g) ΔH=-50a kJ·mol-1
难度: 困难查看答案及解析
-
用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
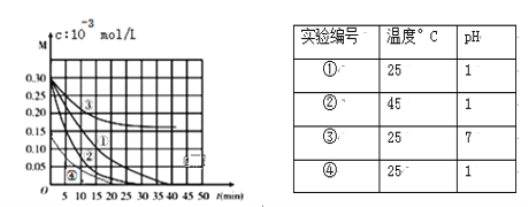
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
难度: 困难查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
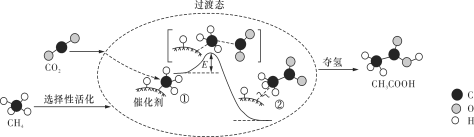
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2
CO+H2O的平衡常数表达式为K==
难度: 中等查看答案及解析
-
下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g)
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
难度: 中等查看答案及解析
-
下列说法正确的是
A. 室温下,1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
B. 25℃时,0.1mol • L-1的HA溶液中
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,BaSO4在水中有沉淀和溶解的平衡:BaSO4(s)
Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
难度: 中等查看答案及解析
-
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是:
A. 此时水的离子积Kw=1×10-14 B. 水电离出的c(H+)=1×10-10mol•L-1
C. 水的电离程度随温度升高而增大 D. c(Na+)=c(SO42-)
难度: 中等查看答案及解析
-
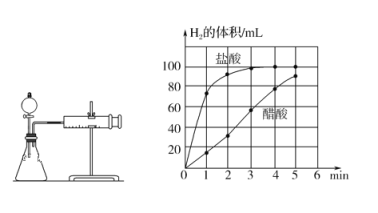
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图所示符合客观事实的是
A.
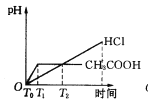 B.
B.  C.
C. 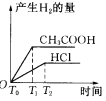 D.
D. 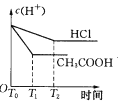
难度: 中等查看答案及解析