-
[2017·新课标Ⅲ]砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________________________。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
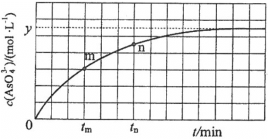
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
-
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
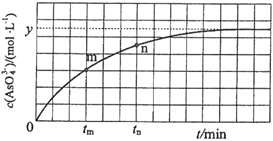
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化 d.c(I−)=y mol·L−1
)不再变化 d.c(I−)=y mol·L−1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
-
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________;
(3)已知:As(s)+  H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+  O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+  O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________;
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:  (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化 d.c(I−)=y mol·L−1
)不再变化 d.c(I−)=y mol·L−1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
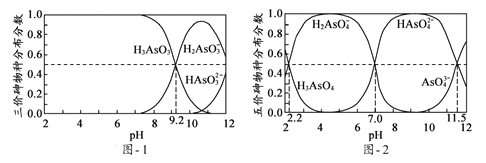
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
(6)溶液的pH对吸附剂X表面所带电荷有影响,pH =7.1时,吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题图-3所示:

试问,提高吸附剂X对三价砷去除效果可采取的措施是______________________。
-
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH- AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c. c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
-
砷 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成 、
、 、
、 、
、 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣 主要成分为
主要成分为 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成 和单质硫
和单质硫 写出发生反应的化学方程式 _____________________________________________
写出发生反应的化学方程式 _____________________________________________  该反应需要在加压下进行,原因是 _______________________________________
该反应需要在加压下进行,原因是 _______________________________________
(3)已知: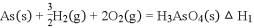

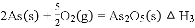
则反应 的
的 ________________________
________________________
(4) 时,将
时,将 、
、
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: 溶液中
溶液中 与反应时间
与反应时间 的关系如图所示.
的关系如图所示.
①下列可判断反应达到平衡的是 ______  填标号
填标号 .
.
 溶液的pH不再变化
溶液的pH不再变化 

 不再变化
不再变化 

② 时,
时, ______
______ 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③ 时,
时, ______
______ 时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是 ____________________
,理由是 ____________________
④若平衡时溶液的 ,则该反应的平衡常数K为 ______________
,则该反应的平衡常数K为 ______________
-
氮是第二周期VA族元素,形成的N2H4、NH3等多种含氮化合物有着广泛的用途。回答下列问题:
(1)画出氮的核外电子排布图:___________。
(2)①肼(N2H4)又称联氨,常温下是一种可燃性液体,其燃烧热较大且产物对环境无污染,常用作火箭燃料。
已知:N2(g)+O2(g)=2NO(g) ΔH1;
2NO(g)+O2(g)=2NO2(g) ΔH2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
则反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=____(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是_____________;正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
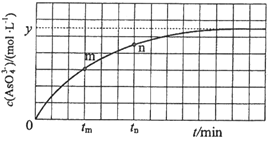
(3)某温度下,分别向三个体积为20 L的密闭容器中充入1 mol N2和2.6 mol H2分别保持恒温恒容、恒温恒压和绝热恒容,均发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。
2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。
①下列表示恒容时反应已达到平衡状态的是______ (填字母)。
A. 氨气的浓度不再变化 B. v(H2)=3v(N2)
C.  的值不再变化D. α(N2)=16.7%
的值不再变化D. α(N2)=16.7%
②图中代表反应在绝热恒容容器中进行的曲线是______(填“a”“b”或“c”)。
③b容器中,M点v正_____(填“大于”“小于”或“等于”)v逆。
④曲线a代表的条件下该反应的平衡常数K=__________。
-
第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
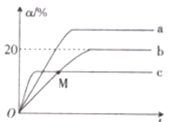
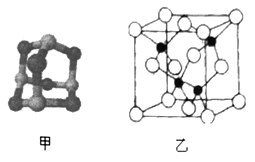
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
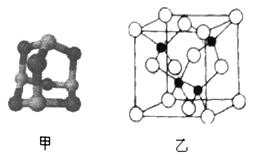
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
-
第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
-
硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)与B一个周期的元素Be和C,它们的电离能由小到达的顺序 ____________________
-
砷为第四周期第ⅤA族元素,则砷不可能具有的性质:
A.砷通常情况下是固体 B.砷可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱 D.砷的非金属性比磷强
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.







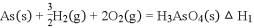
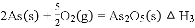
 溶液中
溶液中


