-
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A. Fe与浓盐酸反应比与稀盐酸反应快
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Cu能与浓硝酸反应,但不能与浓盐酸反应
难度: 中等查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. υ(W)=3υ(Z) B. 2υ(X)=3υ(Z) C. 2υ(X)="v(Y)" D. 3υ(W)=2υ(X)
难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是
A. 会引起化学键的变化 B. 会产生新的物质
C. 必然引起物质状态的变化 D. 必然伴随着能量的变化
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
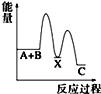 B.
B. 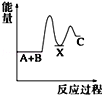
C.
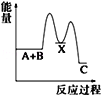 D.
D. 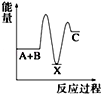
难度: 中等查看答案及解析
-
根据热化学方程式:S(s) + O2(g)= SO2(g);△H=akJ·mol-1(a=-297.2),分析下列说法中不正确的是
A. S(s)在O2(g)中燃烧的反应是放热反应
B. S(g) + O2(g)= SO2(g);△H=bkJ·mol-1,则a<b
C. 1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和
D. 16克固体硫在空气中充分燃烧,可放出148.6kJ的热量
难度: 简单查看答案及解析
-
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A. 55 kJ B. 220 kJ C. 550 kJ D. 1108 kJ
难度: 中等查看答案及解析
-
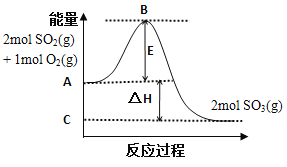
已知热化学方程式SO2(g)+1/2O2(g)
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
A. 等于196.64kJ B. 等于196.64kJ·mol-1
C. 小于196.64kJ D. 大于196.64kJ
难度: 中等查看答案及解析
-
化学反应中的能量变化符合下图所示的是

A. 甲烷燃烧 B. 碳酸钙高温分解
C. 钠与水反应 D. 酸碱中和
难度: 中等查看答案及解析
-
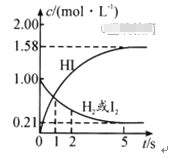
把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,
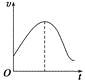
在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①②③ D. ②③
难度: 简单查看答案及解析
-
对于3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)反应的化学平衡常数的表达式为
A. K=
B. K=
C. K=
D. K=
难度: 中等查看答案及解析
-
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
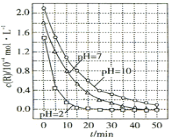
A. 溶液酸性越强,R的降解速率越小
B. 在0-50min时,pH=2和pH=7时R的降解百分率相等
C. R的起始浓度越小,降解速率越大
D. 在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-1
难度: 困难查看答案及解析
-
下列关系中能说明反应N2(g)+3H2(g)
2NH3(g)已经达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图1 所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
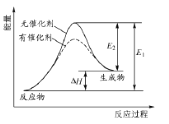
A. 该反应为放热反应
B. 催化剂能改变该反应的焓变
C. 催化剂能降低该反应的活化能
D. 逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
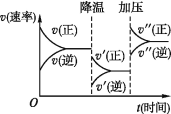
A. 正反应是吸热反应
B. 若A、B是气体,则D是液体或固体
C. 逆反应是放热反应
D. A、B、C、D均为气体
难度: 中等查看答案及解析
-
—定温度下,在一定容积的密闭容器中充入N2和H2,发生反应N2(g)+3H2(g)
2NH3(g),达到平衡时N2的转化率为c%,向平衡混合物中再次充入N2,重新达到平衡后N2的转化率将
A. 增大 B. 减小
C. 不变 D. 无法确定
难度: 中等查看答案及解析