-
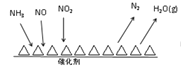
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
A. -332 B. -118 C. +350 D. +130
难度: 困难查看答案及解析
-
化学与生活、生产密切相关,下列说法正确的是( )
A. 食盐、食醋、食用油均可用作食品添加剂,都属于有机物
B. 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用
C. 工业生产玻璃和水泥,均需要用石灰石为原料
D. 海水淡化是解决淡水供应危机的方法之一,向海水中加入明矾可以使海水淡化
难度: 简单查看答案及解析
-
下列药品和装置合理且能完成相应实验的是
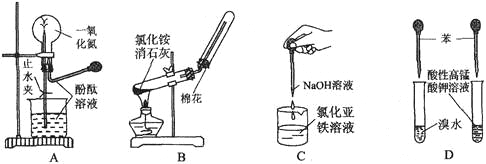
A. 喷泉实验 B. 实验室制取并收集氨气
C. 制备氢氧化亚铁 D. 验证苯中是否有碳碳双键
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 干冰、盐酸都是电解质
B. Na2O2、Fe2O3、CaO既属于碱性氧化物,又属于离子化合物
C. 有单质参加或有单质生成的反应不一定属于氧化还原反应
D. 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
难度: 简单查看答案及解析
-
NA代表阿佛加德罗的值,下列说法正确的是( )
A. 常温常压下,15 g甲基(-CH3)所含的电子数为7NA
B. 水的摩尔质量就是NA个水分子的质量之和
C. 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L
D. 1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子
难度: 中等查看答案及解析
-
用下图表示的一些物质或概念间的从属关系中,不正确的是( )
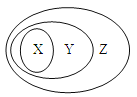
X
Y
Z
例
氧化物
化合物
纯净物
A
苯的同系物
芳香烃
芳香族化合物
B
烯烃
不饱和烃
烃
C
减压蒸馏
常压蒸馏
石油的分馏
D
油脂的皂化
酯的水解
取代反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式为C10H14的单取代芳烃,其可能的结构有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析
-
某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
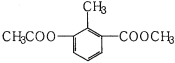
A. 一个分子中含有12个H原子
B. 苯环上的一氯代物有2种
C. 能使酸性KMnO4溶液褪色
D. 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
难度: 困难查看答案及解析
-
下列反应中,属于取代反应的是( )
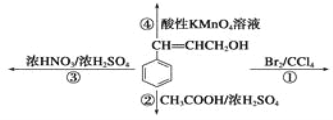
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定条件下一定能大量共存的是( )
A. PH=7的溶液中:Na+、Fe3+、SO42-、NO3-
B. 加入铝粉能产生H2的溶液中:NH4+、Na+、NO3-、Cl-
C. 能使甲基橙显红色的溶液中:K+、NH4+、SO42-、AlO2-
D. c(H+)/ c(OH-)=1×1012 mol·L-1的澄清透明溶液中:Mg2+、Cu2+、SO42-、Cl-
难度: 中等查看答案及解析
-
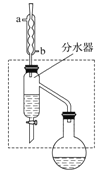
用下列装置进行实验能达到相应实验目的的是( )
A. 用该装置收集NO

B. 分离氢氧化铁胶体和氯化钠溶液
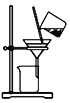
C. 实验室中制取少量蒸馏水
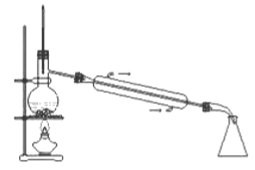
D. 配制100mL0.10mol﹒L-1盐酸
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
难度: 困难查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A. 这个反应是氧化还原反应 B. 制造过程中元素种类没有改变
C. 另一种化合物为NaCl D. 金刚石属于碳的一种同位素
难度: 中等查看答案及解析
-
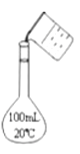
某溶液中可能存在Fe3+、Fe2+、I-、HCO3—、Cl-、NO3—六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中一定大量存在的阴离子是( )
A. I- B. HCO3— C. Cl- D. NO3—
难度: 困难查看答案及解析
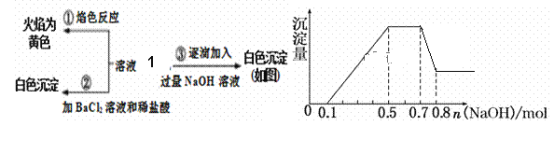
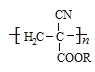 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下: