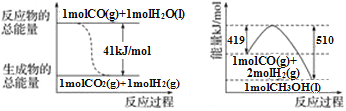
-
下列名称的有机物实际上不可能存在的是( )
A. 2,2—二甲基丁烷 B. 2—甲基—4—乙基—1—己烯
C. 3—甲基—2—戊烯 D. 3,3—二甲基—2—戊烯
难度: 简单查看答案及解析
-
用石墨电极电解某酸溶液时,在相同条件下,阴、阳两极收集到的气体的体积比是2∶1,则下列结论正确的是( )
A. 阴极一定是H2,阳极一定是O2 B. 该酸可能是盐酸
C. 电解后溶液的酸性减弱 D. 阳极的电极反应式为2H++2e-===H2↑
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 各元素的质量分数相等的物质一定是同系物
B. 具有相同分子通式的不同有机物一定属于同系物
C. 同系物具有相同的最简式
D. 两个相邻的同系物的相对分子质量之差为14
难度: 简单查看答案及解析
-
下列化学用语表达不正确的是( )
①丙烷的球棍模型为
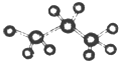
②丙烯的结构简式为CH3CHCH2
③C(CH3)4,叫新戊烷
④
与C8H6互为同分异构体
A. ①② B. ②③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
某烃的结构简式为
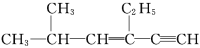 ,有关其分子结构的叙述中正确的是
,有关其分子结构的叙述中正确的是A.分子中一定在同一平面上的碳原子数为6
B.分子中一定在同一平面上的碳原子数为7
C.分子中在同一直线上的碳原子数为6
D.分子中在同一直线上的碳原子数为4
难度: 困难查看答案及解析
-
下列关于同分异构体判断正确的是
A. 甲苯的一氯代物有4种
B. 分子式为C8H10的芳香烃有3种
C. 分子式为C4H8的烯烃同分异构体有2种,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D. 二氯甲烷有两种同分异构体
难度: 简单查看答案及解析
-
实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
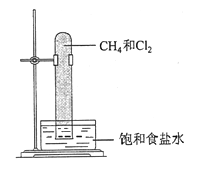
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
A.
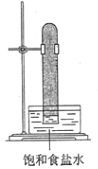 B.
B. 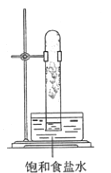 C.
C.  D.
D. 
难度: 简单查看答案及解析
-
主链上有5个碳原子,含甲基、乙基两个支链的烷烃有
A. 5种 B. 4种 C. 3种 D. 2种
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数。下列说法中不正确的是
A. 标准状况下,11.2 L甲烷中含有共价键的数目为2NA
B. 30 g乙烷中含有C—H键的数目为6NA
C. 1 mol CnH2n+2中含有C—C键的数目为(n-1)NA
D. 1 mol CnH2n+2中含有共价键的数目为(3n+2)NA
难度: 简单查看答案及解析
-
下列有关反应和反应类型不相符的是
A. 苯与浓硝酸、浓硫酸混合加热制取硝基苯(取代反应)
B. 在一定条件下,苯与氯气生成六氯环己烷(加成反应)
C. 由乙炔(
)制取氯乙烯(CH2=CHCl) (氧化反应)
D. 在催化剂的作用下由乙烯制取氯乙烷(加成反应)
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 实验室用乙醇和浓硫酸反应制备乙烯,温度计的水银球位于烧瓶的导管口处
B. 甲烷和苯都属于烃,都不存在同分异构体
C. 甲烷和乙烯可以用酸性高锰酸钾溶液鉴别
D. 丙烯和苯分子中的所有原子都在同一平面内
难度: 简单查看答案及解析
-
为了证明液溴与苯发生的反应是取代反应,有如图所示装置。则装置A中盛有的物质是
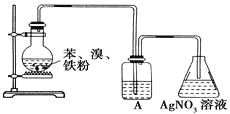
A. 水 B. NaOH溶液 C. CCl4 D. NaI溶液
难度: 中等查看答案及解析
-
已知苯和一卤代烷在催化剂的作用下可生成苯的同系物:
在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
A. CH3CH3和Cl B. CH2=CH2和Cl2 C. CH2=CH2和HCl D. CH3CH3和HCl
难度: 简单查看答案及解析
-
对于苯乙烯(
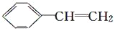 )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥发生加聚反应,产物的结构简式为:
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥发生加聚反应,产物的结构简式为: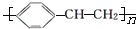 。其中正确的是
。其中正确的是A. ①②③④⑤ B. ①②④⑤ C. ①②⑤⑥ D. 全部正确
难度: 简单查看答案及解析
-
某烷烃结构简式为
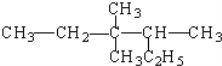 ,其命名正确的是
,其命名正确的是A. 2-乙基-3,3-二甲基戊烷 B. 3,3-二甲基-4-乙基戊烷
C. 3,3,4-三甲基己烷 D. 3,4,4-三甲基己烷
难度: 中等查看答案及解析
-
如图是常见四种有机物的比例模型示意图。下列说法不正确的是
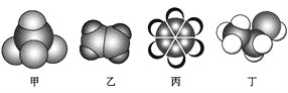
A. 甲能使酸性高锰酸钾溶液褪色
B. 乙可与溴水发生加成反应使溴水褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D. 丁能与金属钾反应放出氢气
难度: 简单查看答案及解析
-
用电解法提取氯化铜废液中的铜,方案正确的是( )
A. 用铜片连接电源的正极,另一电极用铂片
B. 用碳棒连接电源的正极,另一电极用铜片
C. 用氢氧化钠溶液吸收阴极产物
D. 用带火星的木条检验阳极产物
难度: 中等查看答案及解析
-
一种碳钠米管能够吸附氢气可作二次电池(如下图所示)的碳电极。该电池的电解质溶液为6mol/L的KOH溶液,下列说法正确的是
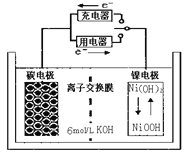
A. 充电时阴极发生氧化反应
B. 充电时将碳电极与电源的正极相连
C. 放电时碳电极反应为:H2-2e-=2H+
D. 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
难度: 中等查看答案及解析
-
某原电池构造如图所示,下列叙述正确的是( )
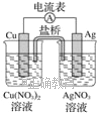
A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
难度: 中等查看答案及解析
-
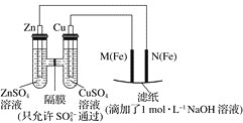
工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
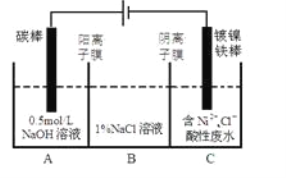
A. 碳棒上发生的电极反应:4OH--4e-==O2↑+2H2O
B. 电解过程中,B室中NaCl的物质的量浓度将不断减小
C. 为了提高Ni的产率,电解过程中需要控制废水的pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是
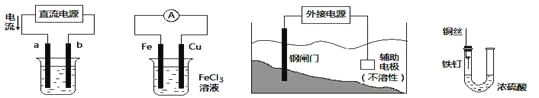
① ② ③ ④
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
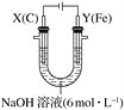
根据下图实验装置判断,下列说法正确的是
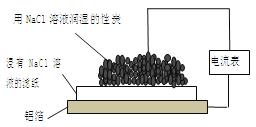
A.该装置能将电能转化为化学能
B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑
C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3
难度: 困难查看答案及解析
-
按如图的装置进行电解实验:A极是铜锌合金,B为纯铜。电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加9.6g,溶液质量增加0.05g,则A极合金中Cu、Zn原子个数比为
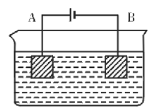
A. 4:1 B. 1:1 C. 2:1 D. 任意比
难度: 中等查看答案及解析
-
如图为纳米二氧化锰燃料电池,其电解质溶液呈酸性,已知(CH2O)n中碳的化合价为0价,有关该电池的说法正确的是
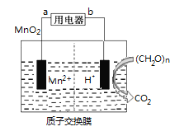
A. 放电过程中左侧溶液的pH降低
B. 当产生22gCO2时,理论上迁移质子的物质的量为4mol
C. 产生22gCO2时,膜左侧溶液的质量变化为:89g
D. 电子在外电路中流动方向为从a到b
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:
A(g)+B(g)
2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
t/min
0
2
4
7
9
n(B)/mol
0.32
0.24
0.22
0.20
0.20
A. 反应前2 min的平均速率v(C)=0.004 mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v (逆)> v (正)
C. 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol
D. 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
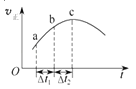
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于b点
C.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D.反应在c点达到平衡状态
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
B. 醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO﹣)+c(CH3COOH)<c(Na+)
C. 相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
D. c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
难度: 困难查看答案及解析
-
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
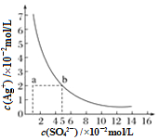
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
难度: 中等查看答案及解析
-
在室温下,相同体积、相同pH的氨水和NaOH溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
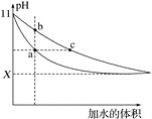
A. 处于a点溶液的导电能力比处于b点溶液的导电能力强
B. 对于b、c两点,氨水的电离常数Kb>Kc
C. 若取相同体积的处于a点和c点的溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积Va<Vc
D. X的值接近7,但小于7
难度: 中等查看答案及解析