-
在 298 K、1.01×105 Pa 下,将 22 g CO2通入 750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出a kJ 的热量。已知在该条件下,1 mol CO2通入 1 L 2 mol·L-1 NaOH 溶液中充分反应放出b kJ 的热量。则 CO2与 NaOH 溶液反应生成 NaHCO3的热化学方程式为
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2b-a)kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2a-b)kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4a-b)kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8a-2b)kJ·mol-1
难度: 困难查看答案及解析
-
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是
A. K+、Ba2+、Cl–、NO3– B. Na+、Ca2+、I–、NO3–
C. NH4+、Al3+、Br–、SO42– D. K+、Na+、HCO3–、SO42–
难度: 中等查看答案及解析
-
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是
A. 上述热化学方程式中的计量数表示分子数
B. ΔH1>ΔH2
C. ΔH2=-57.3 kJ·mol-1
D. |ΔH1|>|ΔH2|
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A. ①②③④ B. ④⑤⑥⑦
C. ③⑤⑥⑦ D. ③④⑤⑥⑦
难度: 简单查看答案及解析
-
某化学反应的能量变化如下图所示。下列有关叙述正确的是
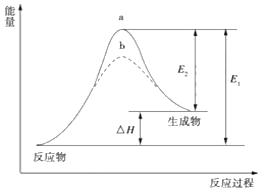
A. 该反应的反应热ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化
C. 催化剂能降低反应的活化能
D. 催化剂能改变反应的焓变
难度: 简单查看答案及解析
-
下列各组热化学方程式中,
的是
①
②
③
④
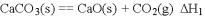
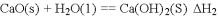
A. ① B. ④ C. ②③④ D. ①②③
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 非自发反应在任何条件下都不能实现
B. 自发反应一定是熵增大,非自发反应一定是熵减小
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 熵增加且放热的反应一定是自发反应
难度: 简单查看答案及解析
-
下列化学反应属于吸热反应的是( )
A. 碘的升华 B. 生石灰溶于水 C. 镁和稀硫酸反应 D. 木炭和二氧化碳反应
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 中等查看答案及解析
-
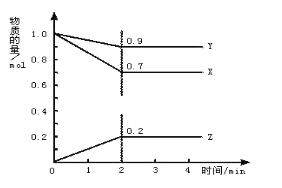
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
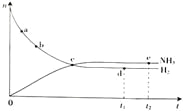
A. 点a的正反应速率比点b的大
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小
难度: 困难查看答案及解析
-
下列事实中,不能用勒夏特列原理加以解释的是
A. 夏天,打开啤酒瓶时会在瓶口逸出气体
B. 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C. 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D. 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
难度: 中等查看答案及解析
-
对于反应,N2O4(g)
2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
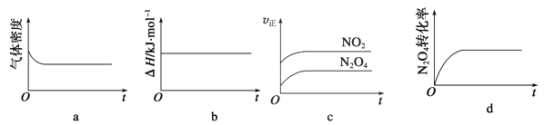
A. ab B. bc C. ac D. ad
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是
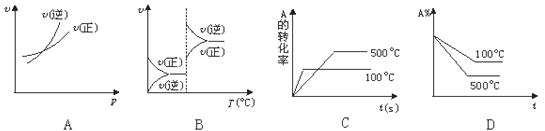
难度: 困难查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应 A(g)+3B(g)
2C(g)达到平衡时,各物质的物质的量之比是 n(A)∶n(B) ∶n(C)=1∶3∶2。保持温度不变,以 1∶3∶2 的物质的量之比再充入 A,B,C,则
A. 平衡向正方向移动 B. 平衡不移动
C. C 的体积分数减小 D. 化学反应速率减小
难度: 中等查看答案及解析
-
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
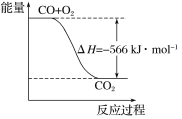
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. 化学计量数关系:a>b
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 困难查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g);ΔH= -373.2 kJ/mol,达到平衡后,为提高该反应的速率和 NO 的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入 N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
一定条件下,在容积为 10L 的密闭容器中,1molX 和 1molY 进行如下反应:2X(g)+Y(g)
Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
A. 以 X 浓度变化表示的反应速率为 0.001mol/(L·s)
B. 将容器容积变为 20L,Z 的平衡浓度为原来的 1/2
C. 若增大压强,则正反应速率增大,逆反应速率减小
D. 若升高温度,X 的体积分数增大,则该反应的ΔH >0
难度: 简单查看答案及解析
-
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
难度: 中等查看答案及解析
-
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是
A. V1>V2 B. V1<V2 C. V1=V2 D. V1≤V2
难度: 中等查看答案及解析