-
当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇(可逆反应),这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式______________________________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3:1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。
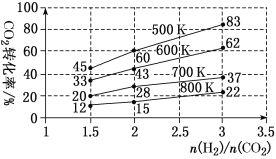
根据图中数据
①降低温度,平衡向________方向移动。
②在700 K、起始投料比 =1.5时,H2的转化率为________。
=1.5时,H2的转化率为________。
③在500 K、起始投料比 =2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
=2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
-
Ⅰ 当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为________________________;
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.CO2与乙醇的浓度之比不再改变
b.单位时间内消耗H2和CO2的物质的量之比为3∶1
c.H2的体积分数保持不变
d.混合气体的平均相对分子质量不再改变

(3)在一定压强下,测得由CO2制取乙醇的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
①升高温度,平衡向________(正或逆)反应方向移动。
②在700 K、起始投料比 =1.5时,H2的体积分数为________(保留小数点后一位)。
=1.5时,H2的体积分数为________(保留小数点后一位)。
③在500 K、起始投料比 =2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
=2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
Ⅱ 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(可逆反应,用化学方程式表示)________________________________,且汽缸内温度越高,单位时间内NO排放量越大,试分析其原因____________________。
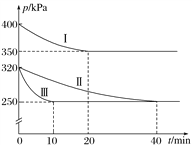
(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理:2NO(g)+2CO(g)  2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①计算实验Ⅱ从开始至达到平衡时的反应速率v(NO)=________________。
②图中三组实验从开始至达到平衡时的反应速率v(NO)由小到大的顺序为________(填序号)。
③与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为:实验Ⅰ_______________________________;实验Ⅲ_______________________。
④三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)、αⅢ(CO)的大小关系为______________。判断依据为__________________________________________。
-
当温度高于 500 K 时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
(1)该反应的化学方程式为________________;其平衡常数表达式为K=________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变 b.H2的浓度不再改变 c.气体的密度不随时间改变 d.单位时间内消耗 H2和 CO2的物质的量之比为 3∶1
(3)已知:1 g 氢气完全燃烧生成液态水,放出 143 kJ 热量;23 g 乙醇完全燃烧生成液态水和二氧化碳,放出 650 kJ 热量,则氢气和乙醇的燃烧热的比值为________。(要求计算出数值)
(4)在一定压强下,测得由 CO2制取 CH3CH2OH 的实验数据中,起始投料比、温度与 CO2的转化率的关系如图所示,根据图中数据
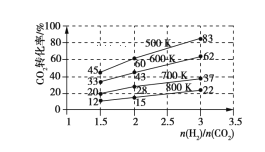
①降低温度,平衡向________方向移动。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 时,H2的转化率为________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 时, 达到平衡后 H2的浓度为a mol·L-1,则达到平衡时 CH3CH2OH 的浓度为________。
-
天然气是一种清洁的化石燃料,也是引起温室效应的一种物质。天然气的综合利用对节能减排、高效利用能源、减少二氧化碳排放有重大意义。作为化工原料,合成甲醇是天然气综合利用的重要途径。
CH4(g)+ CO2(g) 2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
Ⅰ、合成甲醇的主要反应为:2H2(g)+ CO(g) CH3OH(g) △H=-90.8 kJ·mol—1
CH3OH(g) △H=-90.8 kJ·mol—1
(1)该反应熵变△S________0(填“>、=或<”),该反应在______(填“高温”或“低温”)条件下能自发进行。
(2)生产过程中,合成气要循环,其目的是:________________________________。
(3)T℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下,比较此时正、逆反应速率的大小:υ(正)________υ(逆)(填“>”“<”或“=”)
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L—1) | 0.20 | 0.10 | 0.40 |
(4)在恒温恒容条件下,充入一定量的H2和CO,发生上述反应,则该反应达到平衡状态的标志有(__________________)
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.甲醇的浓度保持不变 D.υ正(H2)= υ逆(CH3OH)
(5)在恒温恒容条件下,要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是(______________)
CH3OH(g)中CO的转化率,可以采取的措施是(______________)
A.升温 B.加入催化剂 C.增加CO的浓度
D.增加H2的浓度 E.充入惰性气体 F.分离出甲醇
Ⅱ、合成甲醇的另一反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
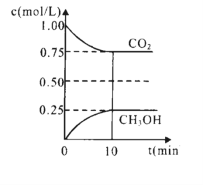
(6)下列措施中能使n(CH3OH )/n(CO2 )增大的是______(填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
(7)经计算该温度下此反应的平衡常数K=0.20 L2·mol—2。若改变条件_________(填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
(8)10min内,用H2表示的该反应的化学反应速率为=_________mol·L—1·min—1
-
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
-
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是
A.利用太阳能制氢 B.关停小火电企业
C.举行“地球一小时”熄灯活动 D.推广使用煤液化技术
-
节能减排对发展经济、保护环境有重要意义.下列措施不能减少二氧化碳排放的是( )
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
-
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是( )。
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
-
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是( )。
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
-
节能减排指的是减少能源浪费和降低废气排放,下列措施与节能减排不符合的是
A.养成随手关灯、关水龙头的习惯
B.开采更多的能源,提高能源开采量
C.尽量乘坐公共交通上班,减少私家车使用率
D.推广使用乙醇汽油从而减轻大气污染,改善大气环境




