-
我国古代科技高度发达,下列有关古代文献的说法,错误的是
A. 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甄(指蒸锅),蒸令气上,用器承滴露。”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯
B. 汉朝的《淮南万毕术》、《神农本草经》记载“白育(碱式碳酸铜)得铁化为铜”,“石胆……能化铁为铜”都是指铜可以采用湿法冶炼
C. 清初《泉州府志志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素
D. 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体。
难度: 困难查看答案及解析
-
设NA代表阿伏加德罗常教的值,N表示粒子数。下列叙述正确的是
A. 在标准状况下,78g苯的碳碳双键数目为3NA
B. 将1molCl2通入水中,则N(HClO)+N(C1-)+N(C1O-)=2NA
C. 将CO2通过Na2O2使其增重ag时,反应中转移电子数为aNA/44
D. 200g 30%的甲醛(HCHO)或醋酸溶液中含有的C原子总数都为2NA
难度: 中等查看答案及解析
-
四元轴烯(a)、苯乙烯(b)、立方烷(c)的分子式均为C8H8,下列说法正确的是
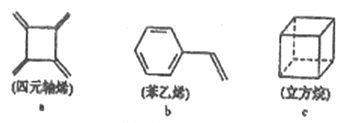
A. a的同分异构体只有b和c两种
B. a、b分子中的所有原子一定处于同一平面
C. a、c的二氯代物均只有三种,b的一氯代物有五种
D. a、b、c均能使溴的四氯化碳溶液褪色
难度: 困难查看答案及解析
-
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是

A. 离子半径:C+>D3+>B2-
B. C的单质的熔点低于D的单质的熔点
C. 电解C、E形成的化合物水溶液可生成C、E对应的单质
D. 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性
难度: 困难查看答案及解析
-
一种生物电化学方法脱除水体中NH4+的原理如下图所示:
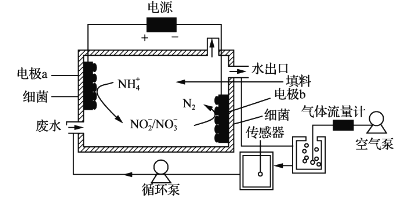
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
难度: 困难查看答案及解析
-
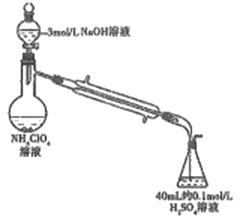
氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀)的装置如图所示。下列说法正确的是
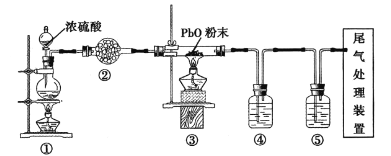
A. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯
B. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯
C. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水
D. 尾气处理可选用点燃、气袋收集、NaOH溶液吸收等方法
难度: 中等查看答案及解析
-
高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随PH的变化如图所示。下列叙述错误的是
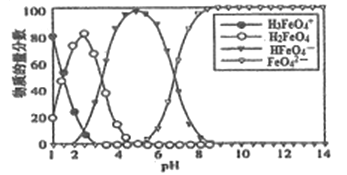
A. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4、K3=5.0×10-8.当pH=4时,溶渡中c(HFeO4-)/c(H2FeO4)=1.2
B. 向pH=5的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
C. PH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
D. 为获得尽可能纯净的高铁酸盐,应控制PH≥9
难度: 中等查看答案及解析
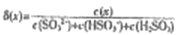 ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。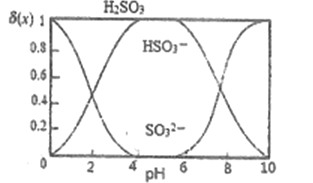
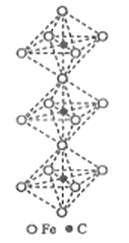
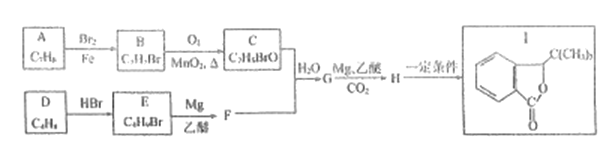
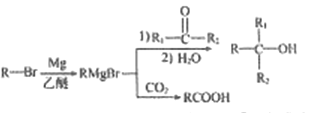
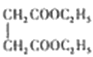 (丁二酸二乙酯)的合成路线_______ (其他无机试剂任选)。
(丁二酸二乙酯)的合成路线_______ (其他无机试剂任选)。