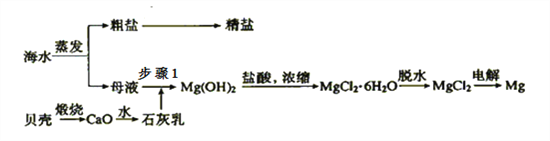
-
NA表示阿伏加德罗常数。下列叙述中正确的是( )
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 4.0 g NaOH固体溶于100 mL水中,得到1 mol·L−1的NaOH溶液
C. 常温、常压下,22 g CO2中含有的氧原子数为NA
D. 1 L 0.5 mol·L−1 Na2SO4溶液中,含有的氧原子总数为2NA
难度: 简单查看答案及解析
-
在xR2++yH++O2===mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是
A. m=4;R2+是还原剂 B. m=y;R3+是氧化产物
C. m=2;R2+是氧化剂 D. m=y;R3+是还原产物
难度: 简单查看答案及解析
-
等质量的CO和N2,下列叙述不正确的是( )
A. 密度一定相同 B. 分子数一定相同
C. 原子数一定相同 D. 物质的量一定相同
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42—
B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42—
C. 含有0.1 mol·L−1 Ca2+的溶液中:Na+、K+、CO32—、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42—
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3 nm)恢复了磁性“钴酞菁”分子的 结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是( )
A. “钴酞菁”分子能透过半透膜
B. “钴酞菁”分子分散在水中所形成的分散系带电
C. 此项工作可以用来改变分子的某些物理性质
D. “钴酞菁”分子分散在水中所形成的分散系为溶液
难度: 中等查看答案及解析
-
逻辑推理是化学学习常用的思维方法,下列推理正确的是( )
A. 氧化物都含有氧元素,含有氧元素的化合物一定是氧化物
B. 氧化还原反应中有元素化合价的改变,有元素化合价改变的化学反应一定是氧化还原反应
C. 电解质是溶于水或熔融状态下能够导电的化合物,溶于水能导电的化合物一定是电解质
D. 中和反应有盐和水生成,有盐和水生成的反应一定是中和反应
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
A. H2SO4的摩尔质量是98
B. S2和S8的混合物共6.4 g,所含硫原子数为0.2NA
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol·L−1
难度: 中等查看答案及解析
-
下列操作能达到实验目的的是( )
A. 除去铝粉中混有的少量铁粉,可加入过量的盐酸溶液,完全反应后过滤
B. 将碘的饱和水溶液中的碘提取出来,可用四氯化碳进行萃取
C. 制备Fe(OH)3胶体,通常是将FeCl3溶液注入热水中,并搅拌均匀
D. 除去Na2CO3溶液中少量的Na2SO4,可加入适量氯化钡,过滤
难度: 简单查看答案及解析
-
实验室制取氧气的反应为 2 KClO3
2 KCl+ 3 O2↑ ,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
A. 溶解、蒸发、洗涤、过滤 B. 溶解、过滤、蒸发、洗涤
C. 溶解、过滤、洗涤、干燥 D. 溶解、洗涤、过滤、加热
难度: 中等查看答案及解析
-
下列实验装置与实验目的对应的是( )
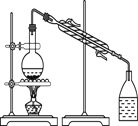
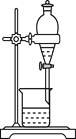
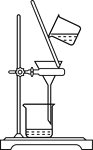
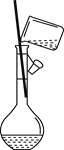
A.用海水制蒸馏水
B.将碘水中的碘单质与水直接分离
C.除去Fe(OH)3胶体中的FeCl3
D.稀释浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 钠和冷水反应:Na+2H2O===Na++2OH-+H2↑
B. 氯化铝与氨水反应:Al3++3OH-===Al(OH)3↓
C. 金属铝溶于盐酸中:2Al+6H+===2Al3++3H2↑
D. 铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
难度: 中等查看答案及解析
-
用NaOH固体配制一定物质的量浓度的溶液,下列操作中正确的是( )
A. 称量时,应先在两盘上放等质量的纸,再将固体NaOH放在天平左盘上称量
B. 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C. 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D. 定容时如果加水超过了刻度线,用胶头滴管再吸出多余部分
难度: 简单查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2 O,下列说法正确的是( )
A. KClO3在反应中失去电子 B. ClO2是氧化产物
C. H2C2O4在反应中被氧化 D. KClO3是还原剂
难度: 困难查看答案及解析
-
有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是在放于温热石棉网上的NH4NO3和Zn粉的混合物中滴几滴水后产生的白烟:NH4NO3+Zn===ZnO+N2↑+2H2O,下列有关说法中正确的是
A. 该反应中NH4NO3只作氧化剂
B. 该反应中只有两种元素化合价改变
C. 每消耗65克锌会产生22.4L N2
D. ZnO是该反应的还原产物
难度: 简单查看答案及解析
-
某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子
Na+
Al3+
Cl-
X
个数
3a
2a
a
b
A. SO42—、4 a B. NO3—、4 a C. OH—、8 a D. SO42—、8 a
难度: 困难查看答案及解析
-
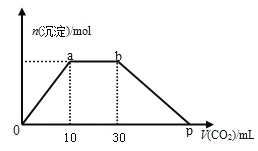
下列图像与其相应的描述对应正确的是( )
A. 向硫酸铜溶液中加入氢氧化铜固体直至过量的过程,溶液的导电性变化

B. 向硫酸溶液中逐渐加水的过程中,溶液密度的变化

C. 一定温度下,向饱和硝酸钾溶液中加入硝酸钾晶体,溶液中溶质质量分数变化

D. 向2L 0.015mol/L石灰水中通入二氧化碳的过程,沉淀质量的变化

难度: 中等查看答案及解析