-
化学与生活密切相关。下列说法不正确的是
A. 氦气化学性质稳定、密度小,可用于填充飞艇、气球
B. 镁铝合金质量轻、强度大,可用作高铁车厢材料
C. 纳米铁粉有较强的物理吸附作用,可去除水体中的Cu2+、Cd2+、Hg2+等重金属离子
D. K2FeO4是强氧化剂,还原产物铁离子水解生成氢氧化铁胶体,可作为净水剂
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,1.12 L CCl4含有质子数的数目为3.7NA
B. 常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA
C. 常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA
D. 晶体B的结构单元如图,则11g晶体B含有0.6NA个三角形(相邻原子构成)
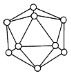
难度: 困难查看答案及解析
-
下列实验操作和实验结论均正确的是
实验操作
实验结论
A
先加少量氯水,再滴加KSCN溶液,出现血红色
证明某溶液中存在Fe2+
B
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
C
向碳酸钙中滴加盐酸,有气泡产生
证明氯的非金属性大于碳
D
将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤
制备氯化镁晶体
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,Y原子次外层电子数与其它各层电子总数相等,W和X的原子序数之和等于Z的原子序数。下列说法正确的是
A. 含氧酸的酸性:Z>W
B. 在一定条件下W的单质能与Y的最高价氧化物对应的水化物反应
C. 四种元素均能与氢元素形成共价键
D. 简单离子半径:X>Y>Z
难度: 中等查看答案及解析
-
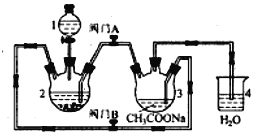
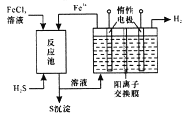
锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
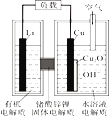
A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
难度: 困难查看答案及解析
-
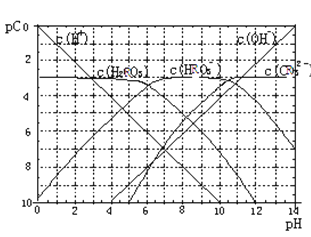
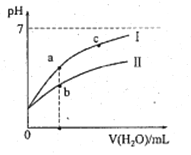
下表为25℃时某些弱酸的电离平衡常数;图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
弱酸的电离平衡常数(25℃)
CH3COOH
HClO
Ka=1.8×10-5
Ka=3.0×10-8
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH- )+c(CH3COO-) > NaClO溶液的c(OH-)+c(C1O-)
难度: 中等查看答案及解析
-
香茅醛(结构如图)可作为合成青蒿素的中间体,关丁香茅醛的下列说法错误的是
A. 分子式为C10H12O
B. 分子中所有碳原子可能处于同一平面
C. 能使溴水、酸性高锰酸钾溶液褪色
D. 1 mol该物质最多与2mol H2发生加成反应
难度: 简单查看答案及解析