-
pC类似pH,是指溶液中溶质物质的量浓度的常用对数的负值,如某溶液的浓度为1×10-2mol/L,则溶液中该溶质的pC=-lg1×10-2=2。已知H2RO3溶液中存在的化学平衡为:
RO2(g)+H2O  H2RO3
H2RO3  H+ +HRO3- ,HRO3-
H+ +HRO3- ,HRO3-  H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
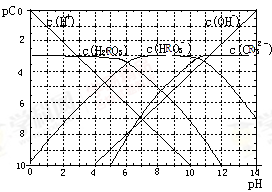
(1)在pH=2~4时,H2RO3溶液中主要存在的离子为:_____;
(2)H2RO3一级电离平衡常数的数值Ka1≈_______;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11。观察上图判断NaHRO3溶液呈_______性;再通过计算,利用电离、水解平衡常数说明理由____________。
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是_________ 。
(5)一定温度下,三种盐MRO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解曲线如图所示。已知:p(M2+)=-lg c(M2+),p(RO32-)= -lgc(RO32-)
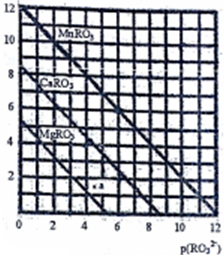
①MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为__________________。
② a 点时c(Mg2+)_____ c(RO32-) (填“>”或“<”或“=”),此时MgRO3溶液__________(填“己达饱和”或“未达饱和”)
③现欲将某溶液中的Mn2+以MnRO3盐的形式沉淀完全(溶液中Mn2+离子的浓度小于l×10-5mol/L),则最后溶液中的p(RO32-)的范围是_________________。
-
pC类似pH,是指溶液中溶质物质的量浓度的常用对数的负值,如某溶液的浓度为1×10-2mol/L,则溶液中该溶质的pC=-lg1×10-2=2已知H2RO3溶液中存在的化学平衡为:RO2(g)+H2O  H2RO3
H2RO3  H+ +HRO3-,HRO3-
H+ +HRO3-,HRO3-  H++RO32-下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
H++RO32-下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
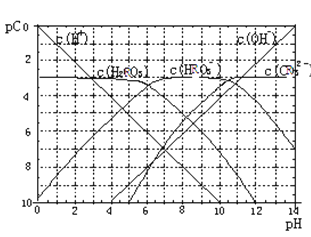
(1)在pH=2~4时,H2RO3溶液中主要存在的离子为:_____;
(2)H2RO3一级电离平衡常数的数值Ka1≈ _______;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11。观察上图判断NaHRO3溶液呈_______性;再通过计算,利用电离、水解平衡常数说明理由____________。
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是_________ 。
(5)一定温度下,三种盐MRO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解曲线如右图所示。已知:p(M2+)=-lg c(M2+),p(RO32-)= -lgc(RO32-)
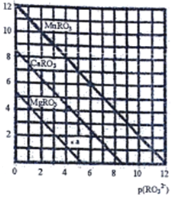
①MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为_______________。
② a 点时c(Mg2+)_____c(RO32-) (填“>”或“<”或“=”),此时MgRO3溶液_______(填“己达饱和”或“未达饱和”)
③现欲将某溶液中的Mn2+以MnRO3盐的形式沉淀完全(溶液中Mn2+离子的浓度小于l×10-5mol/L),则最后溶液中的p(RO32-)的范围是_________________。
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01 mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01 mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,AB难溶性离子化合物的Ksp=1.0×10-10, 其饱和溶液中pC(A+) +pC((B-)=10
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是( )
A.25 ℃时,0.01 mol·L-1 Na2S水溶液中,pC(H+)+pC(OH-)=14
B.用0.01 mol·L-1的NaOH溶液滴定某浓度的盐酸,滴定过程中pC(OH-)逐渐增大
C.某温度下,A2B难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B2-)=10
D.向0.01 mol·L-1的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pC(Ca2+)逐渐减小
-
pc类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液溶质的pc=3。下列说法正确的是
A.25°C时,0.01mol/LNa2S水溶液中,pc(H+)+pc(OH-)=14
B.用0.01mol/L的NaOH溶液滴定某浓度的盐酸,滴定过程中pc(OH-)逐渐增大
C.某温度下,弱酸HB的Ka=1×10-5mol/L,则该溶液中pc(H+)+pc(B-)=l0
D.向0.0lmol/L的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pc(Ca2+)逐渐减小
-
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=-lg (1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是
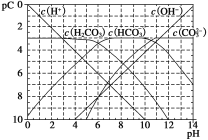
A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
-
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
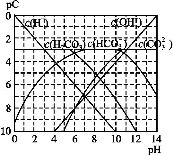
(1)在人体血液中,HC 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确________
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确________
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(C )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
-
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
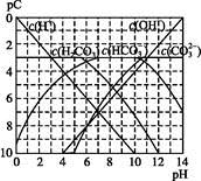
(1)在人体血液中, 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中, 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c( )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1.c( )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
H2RO3
H+ +HRO3-,HRO3-
H++RO32-下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:






