-
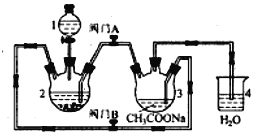
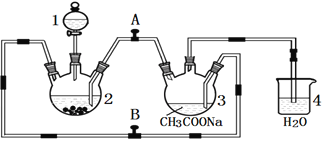
实验室中以Zn、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬晶体,其装置如图所示。仪器2中已预先加入锌粒,仪器3中已加人CH3COONa溶液。
资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]2•2H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]2•2H2O
④Ksp[Cr(OH)3]=6.3×10-31, ≈4,lg2≈0.3
≈4,lg2≈0.3
资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]2•2H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]2•2H2O
④Ksp[Cr(OH)3]=6.3×10-31, ≈4,lg2≈0.3
≈4,lg2≈0.3
回答下列问题:
(l)仪器1的名称是_____________________。
(2)实验时先往仪器2中加盐酸,一段时间后再加CrCl3溶液,目的是______________。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_____,打开阀门_________。
(4)本实验中锌粒要过量,其原因除了使产生的H2将CrCl2 溶液压入装置3与CH3COONa溶液反应外,另一个作用是__________________。
(5)铬的离子会污染水资源。常温下要除去上述实验中多余的Cr2+,①先向废液中通入足量的______,将Cr2+转变为Cr3+,反应的离子方程式为______________;②再加入碱液,调节pH至少为_______才能使Cr3+沉淀完全[c(Cr3+)<10-5mol/L]
-
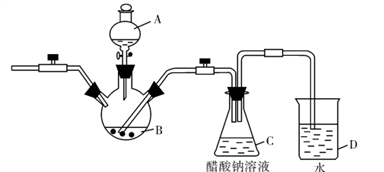
二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
请回答下列问题:
(1)仪器A的名称是______,所盛装的试剂是_______。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是 ___________。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______。
(4)仪器D的主要作用是_______。
(5)指出该装置的不足之处_______。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____(填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚
-
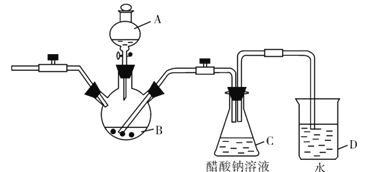
二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
请回答下列问题:
(1)仪器A的名称是______,所盛装的试剂是_______。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是 ___________。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______。
(4)仪器D的主要作用是_______。
(5)指出该装置的不足之处_______。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____(填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚
-
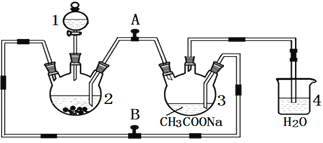
化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31, =4,lg2≈0.3)
=4,lg2≈0.3)
-
化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31, =4,lg2≈0.3)
=4,lg2≈0.3)
-
醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
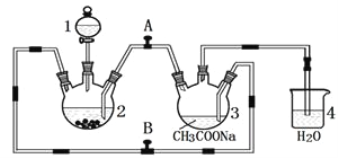
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31, ≈4,lg2≈0.3】
≈4,lg2≈0.3】
-
醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
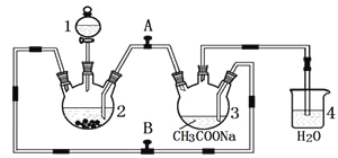
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31, ≈4,lg2≈0.3】
≈4,lg2≈0.3】
-
醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
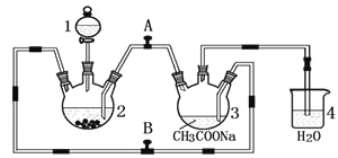
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31, ≈4,lg2≈0.3】
≈4,lg2≈0.3】
-
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
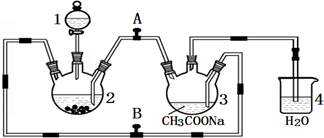
(1)仪器1的名称是_____________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是_____________(选下面的A、B或C);目的是_____________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_____________(填“A”或“B”,下同),打开阀门_____________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_____________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.4g,则该实验所得产品的产率为_____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_____________,再加入碱液,调节pH至少为_____________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。已知Cr(OH)3的溶度积为6.3×10-31, ≈4,lg2≈0.3
≈4,lg2≈0.3
-
醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
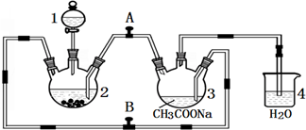
Zn(s)+ 2HCl(aq)= ZnCl2(aq)+ H2(g)
2CrCl3(aq)+ Zn(s) = 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO-(aq)+ 2H2O(l)= [Cr(CH3COO)2]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是 。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是 (选下面的A、B或C);目的是 。 A.盐酸和三氯化铬溶液同时加入B.先加三氯化铬溶液一段时间后再加盐酸 C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门 (填“A”或“B”,下同),打开阀门 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为 (不考虑溶解的醋酸亚铬水合物)。

≈4,lg2≈0.3
≈4,lg2≈0.3








