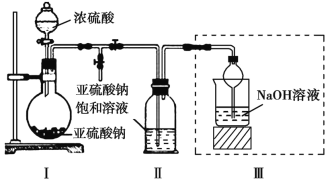
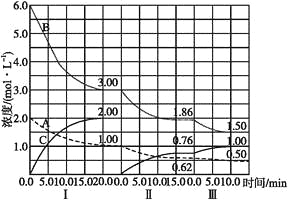
-
下列关于能源和作为能源的物质叙述错误的是
A. 化石能源物质内部蕴涵着大量的能量
B. 吸热反应没有利用价值
C. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
D. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
难度: 简单查看答案及解析
-
对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A. 化学反应速率变化时,化学平衡一定发生移动
B. 正反应进行的程度大,正反应速率一定大
C. 化学平衡发生移动时,化学反应速率一定变化
D. 只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
难度: 中等查看答案及解析
-
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)
CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol−1
②CH4(g)+2O2(g)
CO2(g)+2H2O(l) ΔH=−890.3 kJ·mol−1
③CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH=−890.3 kJ·mol−1
④2H2(g)+O2(g)
2H2O(l) ΔH=−571.6 kJ·mol−1
A. 仅有② B. 仅有②③④ C. 仅有②④ D. 全部符合要求
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 17 g氨气中含有的质子数为10NA
B. 2.4 g金属镁变成镁离子时失去的电子数为0.1NA
C. 0.5 mol·L-1AlCl3溶液中Cl-的数目为1.5NA
D. 标准状况下,11.2 L CCl4所含的分子数为0.5NA
难度: 中等查看答案及解析
-
对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,熵增加的反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程只与焓变有关
难度: 简单查看答案及解析
-
把下列四种X溶液分别迅速加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时,X和盐酸立刻进行反应,其中初始反应速率最快的是
A. 10℃ 10 mL 3 mol·L-1的X溶液 B. 20℃ 10 mL 2 mol·L-1的X溶液
C. 20℃ 10 mL 4 mol·L-1的X溶液 D. 10℃ 10 mL 2 mol·L-1的X溶液
难度: 中等查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达到平衡状态标志的是
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A. ①⑥ B. ②④ C. ③⑧ D. ②⑧
难度: 中等查看答案及解析
-
H2S水溶液中存在电离平衡H2S
H++HS−和HS−
H++S2−。若向H2S溶液中
A. 滴加新制氯水,平衡向左移动,溶液pH减小
B. 加水,平衡向右移动,溶液中氢离子浓度增大
C. 通入过量SO2气体,平衡向左移动,溶液pH增大
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
难度: 中等查看答案及解析
-
已知盐酸是强酸,在下列叙述中说法正确,且能说明醋酸是弱酸的是
A. 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量少
B. 盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取
C. 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
D. 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)
2CO2(g) ΔH=−566 kJ·mol−1;
Na2O2(s)+CO2(g)
Na2CO3(s)+
O2(g) ΔH=−226 kJ·mol−1
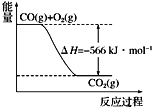
根据以上热化学方程式和图像判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>−452 kJ·mol−1
C. 上图可表示由1 mol CO生成CO2的反应过程和能量关系
D. 根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
难度: 中等查看答案及解析
-
常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是
A. 由水电离产生的c(H+)=10−12 mol·L−1的溶液中:K+、Na+、ClO−、I−
B. c(H+)=
mol·L−1的溶液中:K+、Fe3+、Cl−、
C. pH=13的溶液中:
、Cl−、
、
D. 常温下,c(H+)/c(OH-)=1×10−12的溶液:K+、
、
、Na+
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
B. 反应过程中,若增大压强能提高SiCl4的转化率
C. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
D. 反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
难度: 中等查看答案及解析
-
现有等pH或等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁,产生H2的体积(同温同压下测定)的变化图示如下。其中正确的是

A. ①③ B. ②④ C. ①②③④ D. 都不对
难度: 中等查看答案及解析
-
T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.030
0.039
0.040
0.040
A. 反应在前2s的平均速率
mol·L-1·s-1
B. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038mol·L-1,则反应的△H<0
C. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
D. T K时该反应的化学平衡常数为
难度: 中等查看答案及解析
-
下列实验及现象不能得出相应结论的是
选项
实验操作
现象
结论
A
将一小块金属钠放置在空气中,一段时间后,将其放置在坩埚中加热
钠表面变暗,加热时,钠易与氧气反应,加热时,钠燃烧,发出黄色火焰
钠易与氧气反应,加热时生成Na2O的速率加快
B
向碳酸钠和小苏打溶液中分别加入足量的盐酸
都冒气泡
两者均能与盐酸反应产生使澄清石灰水变浑浊的气体
C
将FeSO4高温分解产生的气体通入品红溶液中
品红溶液褪色
分解产生的气体中含有SO2
D
将KI 和FeCl3溶液在试管中混合后,加 入CCl4振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH- ΔH>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
C. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
D. 将水加热,KW增大,c(H+)不变
难度: 中等查看答案及解析
-
根据vt图分析外界条件改变对可逆反应A(g)+3B(g)
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
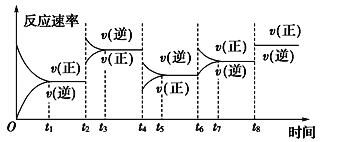
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
难度: 中等查看答案及解析
-
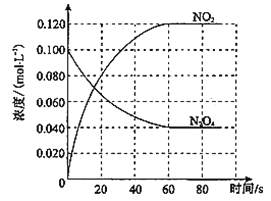
在密闭容器中,反应X(g)+2Y(g)
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
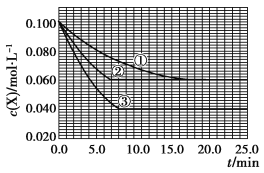
下列说法正确的是
A. 若反应①、②的平衡常数分别为K1、K2,则K1<K2
B. 实验②平衡时Y的转化率为60%
C. 减小反应③的压强,可以使平衡时c(X)=0.060 mol·L-1
D. 反应X(g)+2Y(g)
Z(g)的ΔH>0
难度: 中等查看答案及解析
-
下列说法中不正确的有
①卤素单质从上到下熔沸点逐渐升高,碱金属单质从上到下熔沸点逐渐降低
②铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mLCl2,恰好将Fe完全氧化,x的值为0.80
③SiO2有导电性,可用于制备光导纤维
④二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物
⑤金属活动性不同,冶炼方法也有所不同
⑥苏打和小苏打焰色反应的现象是相同的,说明灼烧过程中它们发生了相同的化学变化
⑦铁在纯氧中燃烧或在氯气中燃烧所得产物中铁的化合价均为+3价
⑧镁铝合金的强度和硬度都比纯铝和纯镁的大
⑨除去铜器表面铜绿而不损伤器物,可用稀硝酸
⑩Al(OH)3药剂适合于胃溃疡患者服用,治疗胃酸过多
A. ③④⑥⑦⑨ B. ①②③⑤ C. ④⑥⑦⑧⑨ D. ①②⑤⑧⑩
难度: 中等查看答案及解析
-
下列实验操作规范且能达到目的的是
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
C.
配制浓度为0.010mol/L的高锰酸钾溶液
称取高锰酸钾固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
D.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定温度下,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。在a、b中分别加入2 mol A和2 molB,起始时容器体积均为V L,发生反应2A+B
x C,并达到化学平衡状态,平衡时两容器中A、B、C的物质的量之比均为1:3:6。

下列说法一定正确的是
A. x的值为2 B. a、b容器中从起始到平衡所需时间相同
C. B物质可为固体或液体 D. 平衡时,b容器的体积小于V L
难度: 中等查看答案及解析
-
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器
甲
乙
丙
反应物投入量
3 mol A、2 mol B
6 mol A、4 mol B
2 mol C
到达平衡的时间/min
5
8
A的浓度/(mol·L-1)
c1
c2
C的体积分数
w1
w3
混合气体密度/(g·L-1)
ρ1
ρ2
下列说法正确的是
A. 无论x的值是多少,均有2ρ1=ρ2
B. 若x<4,则2c1<c2
C. 若w3=w1,可断定x=4
D. 容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列说法正确的是
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液2〜3滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3
FeCl3(aq)
无水FeCl3
④制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
⑤向一定量的Cu、Fe2O3的混合物中加入300 mL1.mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含有Fe3+。若用过量的CO在高温下还原相同质量的此混合物,固体减少的质量为2.4g
⑥磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=== Fe3++NO↑+3H2O
⑦氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑧Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应制取Fe(OH)3
⑨赤铁矿的主要成分是Fe3O4,Fe3O4为红棕色晶体
A. ①④⑦ B. ⑤⑧ C. ②③⑥ D. ⑤⑥⑨
难度: 中等查看答案及解析