-
属于工业固氮的是
A. 用N2和H2合成氨 B. 闪电将空气中N2转化为NO
C. 用NH3和CO2合成尿素 D. 固氮菌将氮气变成氨
难度: 简单查看答案及解析
-
能使品红溶液褪色的物质是
①漂粉精 ②过氧化钠 ③新制氯水 ④二氧化硫
A. ①③④ B. ②③④ C. ①②③ D. ①②③④
难度: 简单查看答案及解析
-
19世纪中叶,门捷列夫的突出贡献是
A. 提出了原子学说 B. 提出了元素周期律
C. 提出了分子学说 D. 提出了化学平衡移动原理
难度: 简单查看答案及解析
-
仅通过物理方法就能从海水中获得的物质是
A.钠、镁 B.溴、碘 C.食盐、淡水 D.氯气、烧碱
难度: 简单查看答案及解析
-
某原子最外层电子排布为2s22p3,则该原子
A. 核外有5个电子
B. 核外有3种能量不同的电子
C. 最外层电子占据3个轨道
D. 最外层上有3种运动状态不同的电子
难度: 简单查看答案及解析
-
一定条件下不能与苯发生反应的是( )
A. 酸性KMnO4 B. Br2 C. 浓HNO3 D. H2
难度: 中等查看答案及解析
-
单质铁不同于铝的性质是
A. 遇冷的浓硫酸钝化 B. 能与氢氧化钠反应
C. 能与盐酸反应 D. 能在氧气中燃烧
难度: 简单查看答案及解析
-
只用一种试剂即可区别的:NaCl、MgCl2、FeCl3、Al2(SO4)3四种溶液,这种试剂是
A. AgNO3 B. NaOH C. BaCl2 D. HCl
难度: 中等查看答案及解析
-
熔化时需破坏共价键的晶体是
A. NaOH B. CO2 C. SiO2 D. NaCl
难度: 简单查看答案及解析
-
SO2催化氧化过程中,不符合工业生产实际的是
A. 采用热交换器循环利用能量 B. 压强控制为20~50MPa
C. 反应温度控制在450℃左右 D. 使用V2O5作催化剂
难度: 简单查看答案及解析
-
无色透明的某强酸性溶液中能大量共存的离子组是
A. Na+、K+、OH-、Cl- B. Na+、Cu2+、SO42-、NO3-
C. Ca2+、HCO3-、NO3-、K+ D. Mg2+、Na+、SO42-、Cl-
难度: 简单查看答案及解析
-
关于钢铁电化学保护两种方法的说法错误的是
A. 牺牲阳极阴极保护法利用的是原电池原理
B. 外加电流阴极保护法利用的是电解原理
C. 牺牲阳极阴极保护法中钢铁为负极
D. 外加电流阴极保护法中钢铁为阴极
难度: 简单查看答案及解析
-
催化加氢不能得到2-甲基戊烷的是( )
A. CH3CH=C(CH3)CH2CH3 B. (CH3)2C=CHCH2CH3
C. CH≡C(CH3)(CH2)2CH3 D. CH3CH=CHCH(CH3)2
难度: 简单查看答案及解析
-
下列离子方程式书写错误的是:( )
A. 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-=2AlO2-+3H2↑
B. Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
D. AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
难度: 简单查看答案及解析
-
用NaOH标准溶液滴定盐酸,以下操作导致测定结果偏高的是
A. 滴定管用待装液润洗 B. 锥形瓶用待测液润洗
C. 滴定结束滴定管末端有气泡 D. 滴定时锥形瓶中有液体溅出
难度: 简单查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,可通过以下反应制得ClO2: 2KClO3+ H2C2O4+ H2SO4=2ClO2+ K2SO4+ 2CO2+2H2O
下列说法错误的是
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4在反应中被氧化 D. 1mol KClO3参加反应有2mol 电子转移
难度: 简单查看答案及解析
-
关于盐酸与醋酸两种稀溶液的说法中正确的是
A. 相同物质的量浓度的两游液中c(H+)相同
B. 相同物质的量的两溶液中和氢氧化钠的物质的量相同
C. pH=3 的两溶液稀释100倍,pH均变为5
D. 两溶液中分别加入少量对应的钠盐固体,c(H+)均减小
难度: 简单查看答案及解析
-
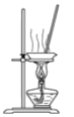
为模拟氨碱法制取纯碱的主要反应,设计在图所示装置。有关说法正确的是( )
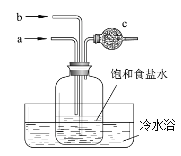
A. 先从b管通入NH3再从a管通入CO2
B. 先从a管通入CO2再从b管通入NH3
C. 反应一段时间广口瓶内有晶体析出
D. c中装有碱石灰以吸收未反应的氨气
难度: 中等查看答案及解析
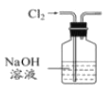
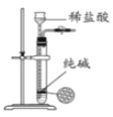
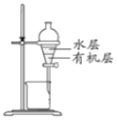
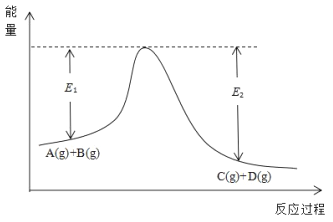


 )___________________
)___________________