-
下列仪器可用于吸取和滴加少量液体的是( )
A. 烧杯 B. 试管 C. 集气瓶 D. 胶头滴管
难度: 简单查看答案及解析
-
下列过程主要属于化学变化的是
A. 石油分馏 B. 碘的升华 C. 氧气液化 D. 铜器锈蚀
难度: 简单查看答案及解析
-
空气是人类生存所必需的重要资源。下列措施不利于建设“蓝天工程”的是
A. 生产中加大直接燃烧煤炭的使用量 B. 严禁露天焚烧农作物秸杆
C. 加强植树造林,增大绿化面积 D. 大力推行汽车使用天然气或氢气为燃料
难度: 简单查看答案及解析
-
儿童缺少某种微量元素会发育停滯,严重的可致侏儒症,该元素是
A. 铁 B. 钙 C. 碘 D. 锌
难度: 简单查看答案及解析
-
下列食物主要提供蛋白质的是
A. 菜油 B. 牛奶 C. 大米 D. 蔬菜
难度: 简单查看答案及解析
-
下列物质由分子构成的是
A. NaOH B. Cu C. CO D. K2CO3
难度: 简单查看答案及解析
-
下列清洗方法中,利用乳化作用的是
A. 用洗洁精清洗油腻的餐具 B. 用汽油清洗油污
C. 用自来水清洗手上的泥土 D. 用食醋清除水垢
难度: 中等查看答案及解析
-
水是生命之源,下列物质可用H2O表示的是
A. 可燃冰 B. 干冰 C. 冰水 D. 水银
难度: 简单查看答案及解析
-
下列常见物质的俗名与化学式对应正确的是
A. 烧碱 Na2CO3 B. 小苏打 NaHCO3 C. 熟石灰CaO D. 铜绿CuSO4·5H2O
难度: 简单查看答案及解析
-
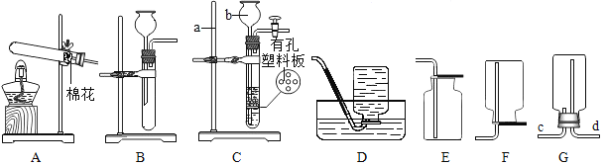
下列图示的实验操作正确的是
A.
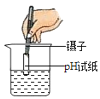 测溶液的pH B.
测溶液的pH B. 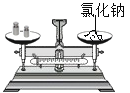 称取氯化钠
称取氯化钠C.
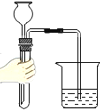 检查气密性 D.
检查气密性 D. 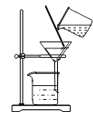 过滤悬浊液
过滤悬浊液难度: 简单查看答案及解析
-
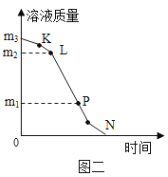
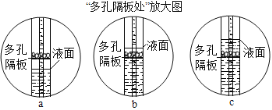
如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
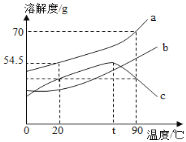
A. a不属于易溶性固体
B. t℃时c物质的饱和溶液,可采用升高温度方法将其变为不饱和溶液
C. 将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
D. 90℃时,将50ga物质加入到50g水中充分搅拌,可得到100ga的饱和溶液
难度: 中等查看答案及解析
-
科学史上每次重大的发现都极大地推进了科学的发展。门捷列夫对科学的突出贡献在于
A. 发现元素周期律 B. 开发联合制碱法 C. 揭示空气的主要成分 D. 提取青蒿素
难度: 简单查看答案及解析
-
下列做法错误的是
A. 用灼烧的方法区分羊毛和涤纶 B. 用肥皂水区分硬水和软水
C. 用品尝的方法区分糖水和石灰水 D. 用碘水区分奶粉和淀粉
难度: 中等查看答案及解析
-
在给定条件下,下列物质间的转化不能一步实现的是
A. Na2CO3
NaOH B. CO2
O2
C. Fe
Fe(NO3)3 D. Zn
H2
难度: 困难查看答案及解析
-
下列措施会降低化学反应速率的是
A. 将常温下的食品放进冰箱中贮藏 B. 双氧水制氧气时加入少量二氧化锰
C. 铁粉代替铁钉与稀硫酸反应 D. 试管中进行氧化铜与稀硫酸反应时,稍微加热
难度: 简单查看答案及解析
-
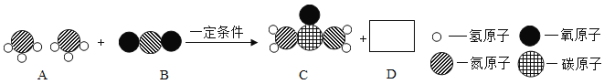
小林査阅资料获得有关物质燃烧的新信息:
①2Na+Cl2
2NaCl ②2MgCO3+CO2
2MgO+C,由此形成以下认识,其中错误的是
A. 燃烧不一定要有氧气参加 B. 使用二氧化碳灭火有局限性
C. 反应①是化合反应 D. 反应①可用于工业生产大量食盐
难度: 中等查看答案及解析
-
维生素B9也叫叶酸,其化学式为C19H19N7O6。下列有关叶酸的说法中正确的是
A. 叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成
B. 叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6
C. 叶酸中氮元素的质量分数大于氧元素的质量分数
D. 叶酸的相对分子质量为441g
难度: 简单查看答案及解析
-
建立模型是学习化学的重要方法。下列有关模型正确的是( )
A.
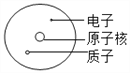 原子结构模型 B.
原子结构模型 B. 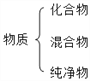 物质分类模型
物质分类模型C.
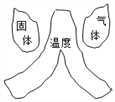 燃烧条件模型 D.
燃烧条件模型 D.  空气组成模型
空气组成模型难度: 中等查看答案及解析
-
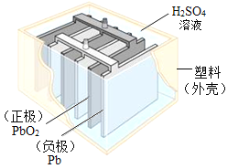
图中字母代表含硫元素的物质,下列判断错误的是
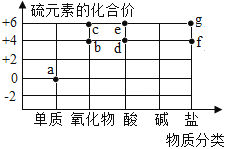
A. 物质a在氧气中燃烧可以生成物质c
B. 物质b是形成酸雨的主要物质之一
C. 物质g中不一定含有金属元素
D. 物质d、e中都一定含有氢、氧元素
难度: 中等查看答案及解析
-
CuCl2是一种重要的化工原料,工业上常在FeCl3催化作用下,向Cu与稀盐酸的混合物中持续通入空气的条件下制得,反应原理如图所示。下列说法错误的是
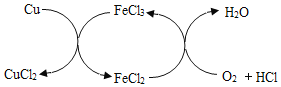
A. 反应过程中不需要持续添加FeCl3溶液
B. 该实验说明Cu能与稀盐酸发生置换反应
C. 缓缓通入空气,能提高铜的利用率
D. 制备CuCl2的总反应为2Cu+O2+4HCl
2uCl2+2H2O
难度: 中等查看答案及解析