-
下列物质中都存在离子键、极性键和配位键的是( )
A. 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
B. 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
C. 硫酸、氢氧化钠、氮化钙、氢氧化钡
D. 氯化铵、氢氧化钠、双氧水、过氧化钙
难度: 简单查看答案及解析
-
在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A. 仅有一个σ键 B. 仅有一个π键
C. 一个σ键,一个π键 D. 一个σ键,两个π键
难度: 简单查看答案及解析
-
符号为 N 的能层,所含的原子轨道数为( )
A. 4 B. 8 C. 16 D. 32
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是( )
A. Br-的核外电子排布式为:[Ar]4s24p6
B. Na 的简化电子排布式: [Na]3s1
C. 氮原子的最外层电子轨道表示式为:
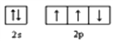
D. 价电子排布为 4s24p3 的元素位于第四周期第 VA 族,是 p 区元素
难度: 简单查看答案及解析
-
下列关于原子结构的说法正确的是( )
A. 前四周期的元素中,未成对电子数等于其电子层数的元素共有 6 种
B. N2 和 PCl5 中,每个原子的最外层都具有 8 电子稳定结构
C. 氢原子电子云的一个小黑点表示一个电子
D. 由能量最低原理可知:同一能层上,电子总是先排布在 s 能级上,然后再排 p 能级
难度: 简单查看答案及解析
-
下列表达方式或说法正确的是( )
A. 基态到激发态产生的光谱是发射光谱
B. 氯化铵的电子式:
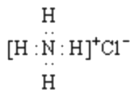
C. NH3、H2O、CO2、HCl 四分子中孤电子对最多的是 CO2
D. 硫离子的核外电子排布式 1s22s22p63s23p4
难度: 中等查看答案及解析
-
下列有关描述正确的是( )
A. ①Na,K,Pb ②N,P,As ③O,S,Se ④Na,P,S元素的电负性随原子序数增大而递增的是④
B. 电负性:F>N>O
C. 同一周期主族元素从左到右,原子半径由大到小,非金属性由弱到强,第一电离能由小到大递增
D. 某元素的逐级电离能分别为 738、1451、7733、10540、13630、17995、21703,该元素可能在第三周期第 IIIA 族
难度: 简单查看答案及解析
-
下列描述中不正确的是( )
A. 标况下,22.4L C2H2 中所含的 π 键数和 18g 冰中所含的氢键数均为 2NA
B. 双原子或多原子形成的气体单质中,一定有 σ 键,可能有 π 键
C. NH4+与 H3O + 均为 10 电子粒子,它们互为等电子体
D. 一个 P4S3 分子(结构如图)中含有三个非极性共价键

难度: 简单查看答案及解析
-
下列物质性质的变化规律正确,且与共价键的键能大小有关的是( )
A. F2、Cl2、Br2、I2 的熔点、沸点逐渐升高
B. HF、HCl、HBr、HI 的热稳定性依次增强
C. 乙醇可以与水以任意比互溶
D. 氢碘酸比盐酸的酸性强,HI 溶于水比 HCl 溶于水时更容易电离
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 分子固体中只存在分子间作用力,不含有其它化学键
B. 形成共价键的元素一定是非金属元素
C. 共价键的饱和性与原子轨道的重叠程度有关
D. σ 键可以单独形成且可以绕键轴旋转,π 键不行
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. NaHCO3 受热分解的过程中,只有离子键被破坏
B. Ba(OH)2 中既存在共价键又存在离子键
C. 液态水汽化时,共价键断开,氢键无变化
D. 干冰熔化时破坏共价键和分子间作用力
难度: 简单查看答案及解析
-
氯的含氧酸根离子有 ClO-、 ClO2- 、 ClO3-、 ClO4- 等,关于它们的说法不正确的是( )
A. ClO4-是 sp3 杂化 B. ClO3- 的空间构型为三角锥形
C. ClO2-的空间构型为直线形 D. ClO- 中 Cl 显+1 价
难度: 简单查看答案及解析
-
下列过程与配合物的形成无关的是( )
A. 除去Fe粉中的SiO2可用于强碱溶液
B. 向一定量的AgNO3溶液中加入氨水至沉淀消失
C. 向Fe3+溶液中加入KSCN溶液
D. 向一定量的CuSO4溶液中加入氨水至沉淀消失
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. SO2 与 CO2 的分子立体构型均为直线形
B. H2O 和 NH3 中的中心原子杂化方式相同
C. CS2 为空间构型为 V 形的极性分子
D. HCN、SiF4 和 SO32- 的中心原子均为 sp3 杂化
难度: 简单查看答案及解析
-
经 X 射线研究证明:PCl5 在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,下列关于 PCl5 的推断正确的是( )
A. PCl5 晶体中不存在离子键
B. PCl5 晶体具有良好的导电性
C. PCl5 晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为 1:1
D. PCl5 晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为 1:1
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. PH4+、 PO43-、XeO4 的空间构型均为正四面体形
B. CO32-、 NO3-、CH2O的空间构型均为平面三角形
C. NH2-、NF3、Cl2O、 I3- 的VSEPR 模型名称均为四面体形
D. 微粒 N2H5、 NH4 、Fe(CO)3、Fe(SCN)3、H3O+、[Ag(NH3)2]OH 中均含有配位键
难度: 简单查看答案及解析
-
下列各组微粒的空间构型相同的是( )
①OF2和H2O ②NH4和 CCl4 ③NH3和H3O+
④O3和SO2 ⑤CO2和C2H4 ⑥SiO44和SO32
A. 全部 B. ①②③④ C. ③④⑤⑥ D. ①②⑤⑥
难度: 简单查看答案及解析
-
下列说法中一定错误的是( )
A. 过渡金属的原子或离子一般都有接受孤电子对的空轨道,易形成配合物
B. 中心离子采取 sp3 杂化轨道形成的配离子可能呈正四面体结构
C. 当中心离子的配位数为 6 时,配离子常呈八面体结构
D. 含有两种配体且配位数为 4 的配离子一定存在异构体
难度: 简单查看答案及解析
-
下列描述中不正确的是( )
A. NH4 键角等于109.28°
B. SnBr2 键角大于 120°
C. SF6 中有 6 对完全相同的成键电子对
D. SiF4 和 SO42 的中心原子均为sp3杂化
难度: 简单查看答案及解析
-
下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

难度: 简单查看答案及解析
-
下列各物质或微粒性质的比较中正确的是( )
A. 沸点:HF<NH3<H2O
B. 粒子半径:K+>Na+>Mg2+>Al3+
C. 酸性:H2SO4>HClO4>H3PO4>H2SiO3
D. 稳定性:H2O<NH3<PH3<SiH4
难度: 简单查看答案及解析
-
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A. SO2 和湿润的 Cl2 都有漂白性,推出二者混合后漂白性更强
B. Fe3Cl8 可以改写为 FeCl2·2FeCl3,推出 Fe3I8 可以改写为 FeI2·2FeI3
C. 由 F、Cl、Br、I 非金属性依次减弱,推出 HF、HCl、HBr、HI 的稳定性依次减弱
D. CO2 通入 Ba(NO3)2 溶液中无沉淀生成,推出 SO2 通入 Ba(NO3)2 溶液中无沉淀生成
难度: 简单查看答案及解析


 ,该同学所画的电子排布图违背了________。
,该同学所画的电子排布图违背了________。