-
下列有关碳和碳的化合物说法错误的是( )
A. 金刚石、石墨、C60都是碳元素组成的单质
B. 在加热或高温的条件下,CO能与许多金属氧化物反应
C. 二氧化碳能使紫色石蕊溶液变红,说明二氧化碳具有酸性
D. 水墨画可长久保存不变色是因为在常温下碳的化学性质不活泼
难度: 中等查看答案及解析
-
某气体由H2、CO2、CO中的一种或两种组成,为确定其成分进行了如下实验:①将气体通过澄清的石灰水,未见浑浊现象;②将气体通过灼热的氧化铜,有红色固体生成;③将气体点燃后的产物通入澄清的石灰水,有浑浊现象。对该气体成分的推断中合理的是( )
A. 一定有CO、CO2 B. 一定有 CO,可能有H2
C. 一定有H2、CO2 D. 一定无 CO2,可能有CO
难度: 中等查看答案及解析
-
开发使用新能源是解决城市大气污染问题的根本途径。下列与新能源有关的说法中, 错误的是
A. 使用氢燃料电池汽车,是解决汽车尾气污染的有效措施
B. 燃料电池系统将化学能转化为电能
C. 垃圾焚烧发电是变废为宝、合理利用能源的一种方式
D. 太阳能、天然气、潮汐能、地热能等,是取之不尽,用之不竭的可再生能源
难度: 中等查看答案及解析
-
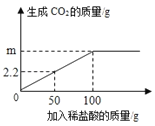
有CO、CO2、N2的混合气体50g,其中碳元素的质量分数为12%.使混合气体与足量灼热的氧化铜完全反应,再将气体通入过量的澄清石灰水中,充分反应后得到的白色沉淀的质量为( )
A. 30 g B. 50 g C. 80 g D. 100 g
难度: 中等查看答案及解析
-
从化学反应
中,得到的信息中叙述错误的是
A. 反应物是铁和氧气,生成物是四氧化三铁
B. 3份Fe跟2份O2反应,生成1份Fe3O4
C. 每168份质量的Fe跟64份质量的O2完全反应,能生成232份质量的Fe3O4
D. 在这个反应中,铁、氧气、四氧化三铁的质量之比为168:64:232
难度: 中等查看答案及解析
-
在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质
X
Y
Z
Q
反应前质量/g
8
2
40
5
反应后质量/g
待测
24
8
23
下列说法正确的是()
①该反应一定是分解反应 ②Y、Q的相对分子质量之比一定为11:9
③Z是反应物,X、Y、Q均为生成物 ④反应后X的质量为0 ⑤参加反应的X、Z的质量比为1:4
A. ①②④ B. ③④ C. ④⑤ D. ②④⑤
难度: 困难查看答案及解析
-
现使1.6g某物质在足量的氧气中充分燃烧,生成4.4gCO2和3.6gH2O,该物质中( )
A. 一定含有C、H元素,可能含有O元素 B. 一定含有C、H、O三种元素
C. 只含C、H两种元素,不含有O元素 D. 无法判断计算
难度: 困难查看答案及解析
-
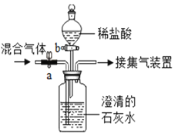
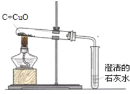
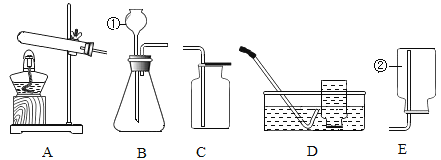
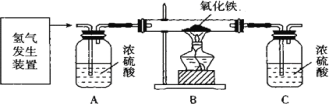
某同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验。对该实验的分析正确的是
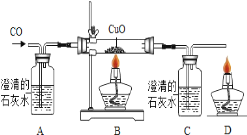
A. 实验结束时应先熄灭D处酒精灯
B. C中增加的质量与B中固体减少的质量相等
C. 反应开始后通入2.8g一氧化碳可生成6.4g铜
D. 省略A装置仍可证明一氧化碳不能和石灰水反应
难度: 困难查看答案及解析
-
如图是甲、乙两种物质的结构示意图,图中小圆圈均代表碳原子,这两种物质在氧气中完全燃烧后的产物都是二氧化碳,但它们的物理性质却明显不同,如导电性、硬度等。据此,下列说法错误的是
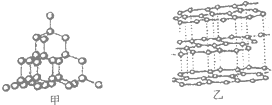
A. 甲乙两种物质中的碳原子大小相同
B. 将甲乙两种物质混合后得到的是纯净物
C. 甲乙两种物质中原子的空间排列方式不同
D. 甲乙两种物质由相同的原子构成
难度: 困难查看答案及解析
-
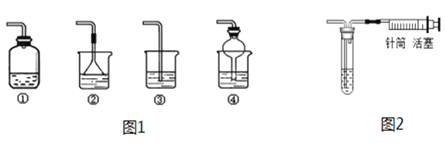
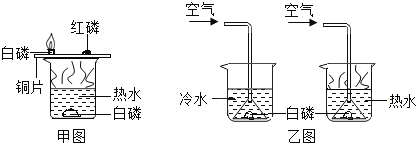
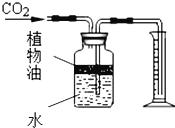
如图所示的实验可用于研究燃烧的条件。下列说法中正确的是( )
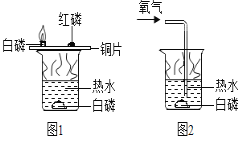
A. 图1和图2中水下白磷对比说明燃烧必须要有氧气参与
B. 图1中铜片上的白磷和红磷对比说明燃烧必须要有氧气参与
C. 图1中铜片上的红磷和水下的白磷对比说明燃烧必须达到可燃物的着火点
D. 此组实验烧杯中的热水只起升高温度的作用
难度: 简单查看答案及解析
-
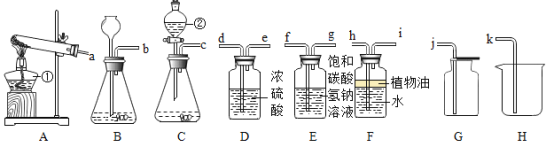
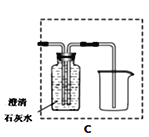
用下图装置进行CO2性质实验。下列说法正确的是
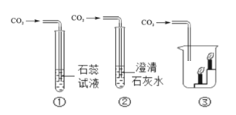
A. ①证明是CO2使石蕊变红 B. ②可用于检验CO2气体
C. ③观察到蜡烛自上而下依次熄灭 D. ①②③只能验证CO2化学性质
难度: 困难查看答案及解析
-
下列图象能正确反映对应变化关系的是
A.
 加热一定质量的高锰酸钾固体
加热一定质量的高锰酸钾固体B.
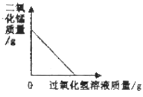 向一定量的二氧化锰中加入过氧化氢溶液.
向一定量的二氧化锰中加入过氧化氢溶液.C.
 向一定量石灰石中滴加稀盐酸至过量
向一定量石灰石中滴加稀盐酸至过量D.
 将水通电一段时间
将水通电一段时间难度: 困难查看答案及解析
-
在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示,下列有关说法不正确的是
物质
甲
乙
丙
丁
反应前的质量/g
40
3
10
15
反应t时刻的质量/g
23
19
a
反应后的质量/g
x
y
28
31
A. 该反应可能是通电分解水 B. x+y=9,a=23
C. 甲一定是化合物 D. 乙可能是该反应的催化剂
难度: 困难查看答案及解析
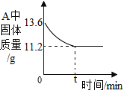
-
已知:
,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是(资料:KClO3和KCl均为白色体)
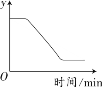
A. 固体中氧元素的质量 B. 生成O2的质量
C. 固体中MnO2的质量 D. 固体中钾元素的质量分数
难度: 困难查看答案及解析
-
“绿色化学”的特点之一是“零排放”.在一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,该产物化学式是( )
A. CH4O B. CH2O2 C. C2H6O D. C2H4O2
难度: 中等查看答案及解析
-
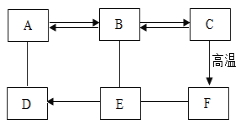
含碳元素物质间转化:
 ,其中碳元素化合价发生变化的是:
,其中碳元素化合价发生变化的是:A. ①② B. ③④ C. ①③ D. ②④
难度: 简单查看答案及解析
 B
B  C
C 
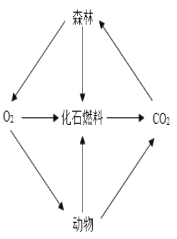
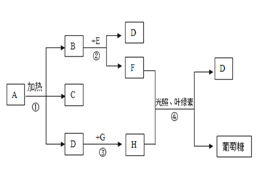
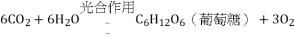 ,生成的葡萄糖供植物生长。②二氧化碳被地球上的海水吸收。产物的化学式为_____,对比上述两种消耗二氧化碳的途径,发现同样是二氧化碳与水的反应,产物却完全不同,其原因是_____。
,生成的葡萄糖供植物生长。②二氧化碳被地球上的海水吸收。产物的化学式为_____,对比上述两种消耗二氧化碳的途径,发现同样是二氧化碳与水的反应,产物却完全不同,其原因是_____。
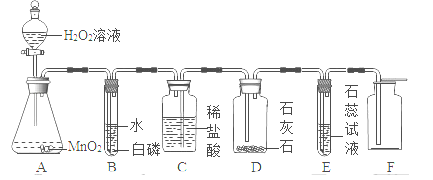
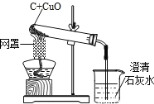
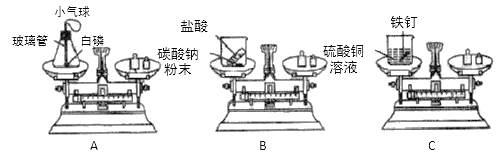
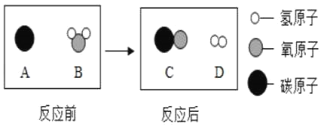
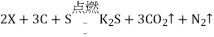 ,则X的化学式是_______。
,则X的化学式是_______。