-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
下列措施不能达到节能减排目的的是
A. 尽可能减少塑料袋 B. 用家用汽车代替公交车
C. 推广使用节能灯 D. 利用太阳能,潮汐能发电
难度: 简单查看答案及解析
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A. 甲醇 B. 天然气 C. 液化石油气 D. 氢气
难度: 简单查看答案及解析
-
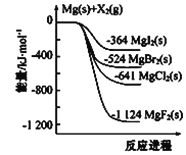
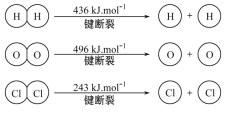
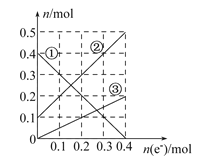
运载火箭以液氢为燃烧剂,液氧为氧化剂。已知:
①H2(g)=H2(l) ΔH=-0. 92 kJ·mol-1 ②O2(g)=O2(l) ΔH=-6. 84 kJ·mol-1
下列说法正确的是
A. 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
B. 氢气的燃烧热为ΔH=-241. 8 kJ·mol-1
C. 火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l)
2H2O(g) ΔH=-474. 92 kJ·mol-1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
难度: 中等查看答案及解析
-
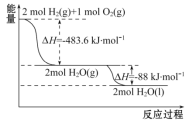
已知X、Y、Z、W有如图所示的转化关系,已知焓变:ΔH=ΔH1+ΔH2,则X、Y不可能是
A. C、CO B. AlCl3、Al(OH)3 C. Fe、Fe(NO3)2 D. Na2O、Na2O2
难度: 中等查看答案及解析
-
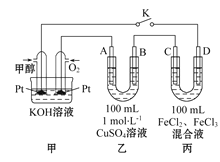
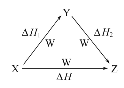
用电化学制备正十二烷的方法:向烧杯中加入50 mL 甲醇,不断搅拌加入少量金属钠,再加入11 mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应: 2C6H13COONa+2CH3OH
C12H26+2CO2↑+H2↑+2CH3ONa,下列说法不正确的是
A. 图中电源的a极为直流电源的负极
B. 电解过程中离子浓度会不断降低
C. 阳极电极反应:2C6H13COO--2e-=C12H26+2CO2↑
D. 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
难度: 中等查看答案及解析
-
工业酸性废水中的Cr2O72—
可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50 mL, Cr2O72—的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验
①
②
③
电解条件
阴、阳极均为
石墨
阴、阳极均为石墨,
滴加1 mL浓硫酸
阴极为石墨,阳极为铁,滴加
1 mL浓硫酸
Cr2O72—的去除率/%
0. 922
12. 7
57. 3
A. 对比实验①②可知,降低pH可以提高Cr2O72—的去除率
B. 实验②中,Cr2O72—在阴极放电的电极反应式是Cr2O72—+6e-+14H+=2Cr3++7H2O
C. 实验③中,Cr2O72—去除率提高的原因是Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72—被还原
难度: 中等查看答案及解析
-
某同学做了如下实验:
装置
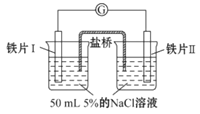
现象
电流计指针未发生偏转
电流计指针发生偏转
下列说法中不正确的是
A. 往铁片Ⅰ所在烧杯加入蒸馏水,电流表指针会发生偏转
B. 用K3[Fe(CN)3]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C. 铁片Ⅰ、Ⅲ的腐蚀速率不相等
D. “电流计指针未发生偏转”,铁片Ⅰ、铁片Ⅱ均未被腐蚀
难度: 中等查看答案及解析
-
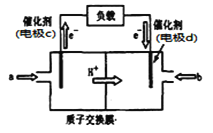
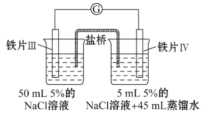
一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
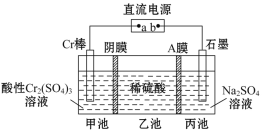
A. a为直流电源的正极
B. 阴极反应式为2H++2e-=H2↑
C. 工作时,乙池中溶液的pH不变
D. 若有1 mol离子通过A膜,理论上阳极生成0. 25 mol气体
难度: 中等查看答案及解析
-
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
Fe2++Cr3+。下列说法正确的是
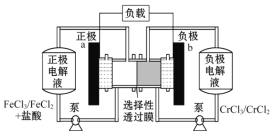
A. 电池充电时,b极的电极反应式为Cr3++e-=Cr2+
B. 电池充电时,Cl-从a极穿过选择性透过膜移向b极
C. 电池放电时,a极的电极反应式为Fe3++3e-=Fe
D. 电池放电时,电路中每通过0. 1 mol电子,Fe3+浓度降低0. 1 mol·L-1
难度: 中等查看答案及解析
-
为了探究外界条件对锌与稀硫酸反应速率的影响,设计如下方案:
编号
纯锌粉
0. 2 mol·L-1硫酸溶液
温度
硫酸铜固体
Ⅰ
2. 0 g
200. 0 mL
25 ℃
0
Ⅱ
2. 0 g
200. 0 mL
35 ℃
0
Ⅲ
2. 0 g
200. 0 mL
35 ℃
0. 2 g
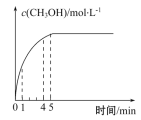
下列叙述不正确的是
A. Ⅰ和Ⅱ实验探究温度对反应速率的影响
B. Ⅱ和Ⅲ实验探究原电池对反应速率的影响
C. 反应速率Ⅲ>Ⅱ>Ⅰ
D. 实验Ⅰ、Ⅱ、Ⅲ的变化图象如图
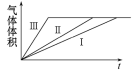
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理来解释的是
A. SO2氧化为SO3,往往需要使用催化剂2SO2(g)+O2(g)
2SO3(g)
B. 500 ℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH<0
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+I2(g)
2HI(g)
D. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O
H++Cl-+HClO
难度: 中等查看答案及解析
-
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)
2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
A. 增大压强,平衡常数将增大
B. 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n mol Cl2
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
难度: 简单查看答案及解析
-
下列叙述及解释正确的是
A. 2NO2(g)(红棕色)
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g)
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
难度: 中等查看答案及解析
-
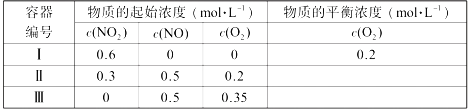
T0 ℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1 ℃、T2 ℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
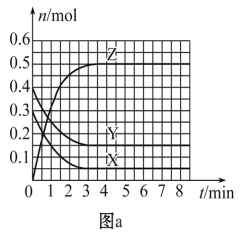
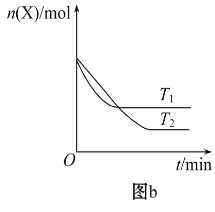
A. 该反应的正反应是吸热反应
B. T0 ℃,从反应开始到平衡时:v(X)=0. 083 mol·L-1·min-1
C. 图a中反应达到平衡时,Y的转化率为37. 5%
D. T1℃时,若该反应的平衡常数K=50,则T1<T0
难度: 中等查看答案及解析
-
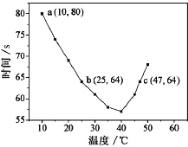
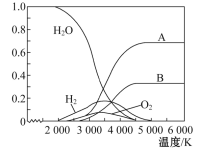
氮气是制备含氮化合物的一种重要物质。两个常见的固氮反应[①N2(g)+3H2(g)
2NH3(g)和②N2(g)+O2(g)
2NO(g)],其平衡常数对数值(lg K)与温度的关系如下图。根据图中的数据判断下列说法正确的是
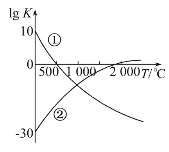
A. 反应①和②均为放热反应
B. 升高温度,反应①的反应速率减小
C. 在常温下,利用反应①固氮和利用反应②固氮,反应程度相差很大
D. 在1 000 ℃时,反应①和反应②体系中N2的浓度一定相等
难度: 中等查看答案及解析
-
一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1
容器2
容器3
反应温度T/K
700
700
800
反应物投入量
2molSO2、1molO2
4molSO3
2molSO2、1molO2
平衡v正(SO2)/mol·L-1·s-1
v1
v2
v3
平衡c(SO3)/mol·L-1
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率a
a 1(SO2)
a 2(SO3)
a 3(SO2)
平衡常数K
K1
K2
K3
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) < α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
难度: 中等查看答案及解析