-
某溶液中由水电离产生的c(OH-)= 1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A Al3+、Na+、NO3-、Cl- B K+、Na+、Cl-、NO3-
C K+、Na+、Cl-、AlO2-D K+、NH4+、SO32-、NO3-ˉ
难度: 中等查看答案及解析
-
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
关于能源的利用,下列说法中错误的是
A. 由于我国煤和石油的储量十分丰富,所以太阳能和核能的开发在我国并不十分重要
B. 能源的利用过程,实质上是能量的转化和传递过程
C. 现在人类社会使用的能源主要是煤、石油和天然气
D. 煤、石油和天然气的化学能归根到底来自太阳能
难度: 简单查看答案及解析
-
下列反应属于放热反应的是
A. C+CO2
2CO B. Zn与稀盐酸反应制备氢气
C. 浓硫酸溶于水 D. 石灰石分解制备氧化钙
难度: 简单查看答案及解析
-
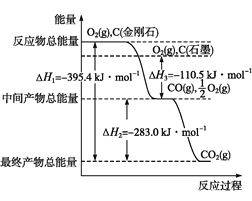
根据热化学方程式S(l)+O2(g)
SO2(g) ΔH1=−293.23 kJ·mol−1,分析下列说法正确的是
A. 反应S(s)+O2(g)
SO2(g)的热效应小于ΔH1
B. 反应S(g)+O2(g)
SO2(g)的热效应大于ΔH1
C. 1 mol SO2(g)的能量小于1 mol S(l)和1 mol O2(g)的能量之和
D. 1 mol SO2 (g)的能量大于1 mol S(l)和1 mol O2(g)的能量之和
难度: 简单查看答案及解析
-
下列有关热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0)kJ/mol
C. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 简单查看答案及解析
-
取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是( )
A.该实验不需要指示剂
B.用量筒量取上述硫酸的体积
C.H2SO4的浓度为1.00 mol·L-1
D.参加反应的H+和OH-的物质的量相等
难度: 中等查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
在一个不传热的固定容积的密闭容器中可逆反应mA(g)+ nB(g)⇌ pC(g)+ qD(g) 当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m mol A断键反应,同时pmol C也断键反应.
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
难度: 简单查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)
2 C6H5CH=CH2(g)+2H2O(g);△H<0
难度: 中等查看答案及解析
-
已知常温常压下,CO2饱和溶液的pH为3.9,试推测用已知浓度的标准盐酸滴定NaHCO3饱和溶液时,适宜使用的指示剂及滴定至终点时溶液颜色的变化情况
A. 石蕊,由蓝色变成红色 B. 甲基橙,由黄色变成橙色
C. 酚酞,由红色变成无色 D. 甲基橙,由橙色变成黄色
难度: 简单查看答案及解析
-
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是

A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
难度: 中等查看答案及解析
-
要证明某酸是弱酸,下列方法正确的是
A. 将串联一小灯泡的该酸溶液与串联一相同小灯泡的硫酸并联,接通电源后,若该溶液上的灯泡较暗,则说明该酸是弱酸
B. 测定该酸的钠盐溶液常温下的pH,若pH>7,则说明该酸是弱酸
C. 用该酸与金属锌反应,产生气泡较慢,则说明该酸是弱酸
D. 中和等体积、等浓度的NaOH溶液消耗该酸的量大于硫酸,则说明该酸是弱酸
难度: 简单查看答案及解析
-
下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D. 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)===C2H5OH(l) ΔH=-44.2 kJ·mol-1
难度: 中等查看答案及解析