-
下列变化,需要加入适当的氧化剂才能完成的是
A. PCl3→PCl5 B. MnO4- →Mn2+ C. SO2→SO32- D. Cl2→HClO
难度: 简单查看答案及解析
-
中华民族有着光辉灿烂的发展史,下列过程不涉及元素化合价变化的是
A. 用胆矾炼铜 B. 点制豆腐
C. 黑火药的使用 D. 用铁矿石炼铁
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 钠在空气中燃烧生成白色的氧化钠
B. 当钠与硫酸铜溶液反应时,有大量红色固体铜出现
C. 实验后剩余的钠粒,需要放回原试剂瓶中
D. 少量金属钠保存在水中
难度: 中等查看答案及解析
-
下列说法正确的是
A. 硫酸、纯碱(Na2CO3)、氯化钠和生石灰分别属于酸、碱、盐和碱性氧化物
B. 用丁达尔效应可区别FeCl3溶液和Fe(OH)3胶体
C. 生石灰与水混合的过程只发生物理变化
D. H2O、C2H5OH、SO3均含有氧元素,都是氧化物
难度: 中等查看答案及解析
-
下列关于Fe(OH)3胶体和MgCl2溶液的说法正确的是
A. 两者都有“丁达尔效应”
B. 两者都能透过半透膜
C. 氢氧化铁胶体粒子在电场作用下向阴极移动,说明氢氧化铁胶体带正电
D. 加入氢氧化钠溶液二者都能沉淀,Fe(OH)3胶体发生聚沉,MgCl2发生化学反应生成沉淀
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A. CO的摩尔质量为28g
B. 1mol·L-1 NaOH溶液中所含有Na+数目为NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的体积约为11.2L
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A. 2.3gNa在足量的氧气中充分燃烧,转移的电子数为0.2NA
B. 标准状况下,22.4 L水中含有的氧原子数为NA
C. 1L 0.5mol•L﹣1的AlCl3溶液中所含Cl¯数目为3NA
D. 0.1 mol 氯气所含有的原子数为0.2NA
难度: 中等查看答案及解析
-
下列物质中,不能由两种单质直接化合得到的是
A. FeCl2 B. CuCl2 C. HCl D. Na2O2
难度: 中等查看答案及解析
-
下列说法正确的是
A. SO2、NO2、CO2都属于酸性氧化物
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 淀粉溶液、雾均属于胶体
D. 液氯、“84”消毒液都属于混合物
难度: 中等查看答案及解析
-
在2L 0.1mol·L-1 BaCl2溶液中,下列说法正确的是
A. Cl¯物质的量为0.2mol
B. Cl¯物质的量浓度为0.2 mol·L-1
C. Ba2+物质的量为0.1mol
D. Ba2+物质的量浓度为0.2 mol·L-1
难度: 中等查看答案及解析
-
下列实验操作中,正确的是
A. 配制5%食盐溶液时,将称量的食盐放入烧杯中,加适量的水搅拌溶解
B. 将氢氧化钠固体放在滤纸上称量
C. 用10mL的量筒量取8.58mL浓盐酸
D. 配制0.1mol·L-1的硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释
难度: 中等查看答案及解析
-
下列物质在水溶液中关于电离方程式错误的是
A. MgCl2 = Mg2+ + 2Cl¯
B. Ba(OH)2 = Ba2+ + 2OH¯
C. CH3COOH = H+ + CH3COO-
D. KHSO4 = K+ + H+ + SO42-
难度: 中等查看答案及解析
-
下列离子方程式,书写正确的是
A. 盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B. 铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C. 氯气与水反应:Cl2 + H2O = 2H++ Cl¯ + ClO¯
D. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH¯+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
难度: 中等查看答案及解析
-
下列各组中的离子,能在水溶液中大量共存的是
A. K+、H+、SO42ˉ、OH¯ B. Na+、Mg2+、NO3ˉ、OHˉ
C. Na+、H+、Clˉ、CO32ˉ D. Na+、Cu2+、SO42ˉ、Clˉ
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是
A. 无色溶液中:Clˉ、Na+、Fe3+、SO42ˉ
B. 含有SO42-的溶液中:Ba2+、Na+、H+、NO3ˉ
C. 含有Clˉ的溶液中: SO42ˉ、NO3ˉ、Cu2+、K+
D. 使石蕊变红的溶液中:Fe3+,HCO3ˉ、Na+,SO42ˉ
难度: 中等查看答案及解析
-
200 ml Fe2(SO4)3溶液中含Fe3+ 56g,溶液中SO42—的物质的量浓度是( )
A. 5mol/L B. 7.5 mol/L C. 10 mol/L D. 2.5 mol/L
难度: 中等查看答案及解析
-
如图所示的实验操作中,正确的是( )
A. 检查容量瓶是否漏水
 B. 给溶液加热
B. 给溶液加热 C. 滴加液体
C. 滴加液体D. 过滤
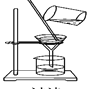
难度: 简单查看答案及解析
-
氯气是一种重要的工业原料。工业上利用反应:3Cl2+2NH3=N2+6HCl,检查氯气管道是否漏气。下列说法错误的是
A. 该反应属于置换反应 B. 该反应利用了Cl2的强氧化性
C. 该反应说明了Cl2的还原性大于N2 D. 生成1molN2有6mol电子转移
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
A.
B.
C.
D.
难度: 简单查看答案及解析
-
有人设想将碳酸钙通过特殊的加工方法使之变为纳米碳酸钙(即碳酸钙的粒子直径是纳米级),这将引起建筑材料的性能发生巨变。下列关于纳米碳酸钙的推测正确的是
A. 纳米碳酸钙是与胶体相似的分散系
B. 纳米碳酸钙的化学性质已与碳酸钙完全不同
C. 纳米碳酸钙分散到水中会产生丁达尔现象
D. 纳米碳酸钙的粒子不能通过滤纸
难度: 中等查看答案及解析
-
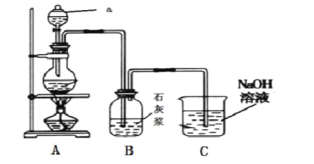
如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是
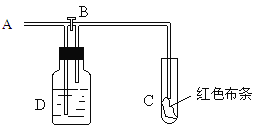
A. D中不可能是浓硫酸
B. 通入的氯气含有水蒸气
C. D中可以是水
D. D中可以是饱和食盐水
难度: 中等查看答案及解析
-
某溶液中仅含Na+、Mg2+、Clˉ、SO42ˉ四种离子,其中Na+浓度为 0.2 mol·Lˉ1 、Mg2+浓度为0.25 mol·Lˉ1 、Clˉ浓度为0.4 mol·Lˉ1 ,则SO42ˉ的浓度为
A. 0.5 mol·Lˉ1 B. 0.3 mol·Lˉ1 C. 0.1 mol·Lˉ1 D. 0.15 mol·Lˉ1
难度: 中等查看答案及解析
-
下列化学反应中,气体被还原的是
A. CO2使Na2O2变白色 B. 点燃时Fe在Cl2中燃烧产生红棕色的烟
C. H2使灼热的CuO粉末变红色 D. CO2能使石灰水变浑浊
难度: 中等查看答案及解析
-
在氢氧化钡溶液中滴入硫酸溶液并测定溶液导电性,下面各图表示的是随着硫酸滴入量的增加溶液导电能力变化的图像,其图像表示正确的是
A.
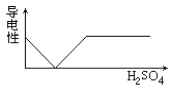 B.
B. C.
D.
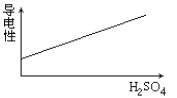
难度: 中等查看答案及解析
-
已知反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
A. 反应①中Se是氧化产物,I2是还原产物
B. 反应②中浓H2SO4是氧化剂,SeO2是还原产物
C. 反应①中每有1.0mol I2生成,转移电子数目为4NA
D. SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
难度: 中等查看答案及解析