-
化学与生产、生活密切相关,下列与化学有关的说法错误的是
A. 水玻璃可作木材防腐剂和阻燃剂
B. “大漠孤烟直”描述的是物质升华的过程
C. 蒸馏法是常用的海水淡化的方法之一
D. 黏土既是制水泥的原料又是制陶瓷的原料
难度: 中等查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M元素的原子是短周期中原子半径最大的。下列说法正确的是
A. X、Z、W三元素形成的化合物都是共价化合物
B. 简单离子的半径从大到小的顺序是:M>Y>Z>W
C. 氢化物的稳定性强弱顺序为:Y>Z>W
D. M2W2既含有离子键,也含有非极性键
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B. 常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA
C. 物质的量浓度为0.1mol•L﹣1的MgCl2溶液中,含有Cl﹣个数为0.2NA
D. 标准状况下,2.24LSO3中含有的氧原子数目为0.3NA
难度: 简单查看答案及解析
-
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2﹣、CO32﹣、NO3﹣七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.下列判断正确的是
A. 一定不含Fe3+和Fe2+
B. 一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C. 溶液可能含有NO3﹣
D. 溶液中共含有4种离子(不考虑水的电离)
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
选项
实验
现象
结论或解释
A
将0.1 mol·L-1MgSO4溶液滴入过量NaOH溶液,再滴加几滴0.1 mol·L-1CuSO4溶液
先有白色沉淀生成,后有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
B
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落下来
铝箔表面有致密Al2O3薄膜,且Al2O3
熔点高于Al
C
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
D
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右上图所示,其中A、B为多孔导电材料。下列说法一定正确的是
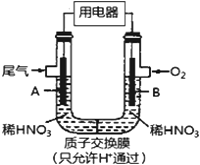
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ ,NO-3e-+2H2O=NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标况),可以除去含1molNO和NO2的混合尾气
难度: 简单查看答案及解析
-
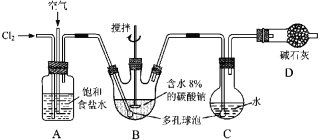
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
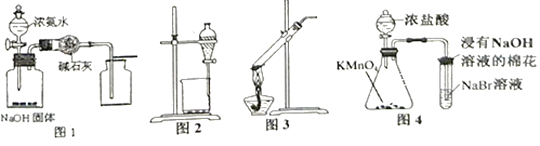
A. 用图1所示装置制取并收集少量纯净的氨气
B. 用图2 所示装置分离乙醇和乙酸乙酯的混合溶液
C. 用图3所示装置加热分解NaHCO3固体
D. 用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱
难度: 中等查看答案及解析