-
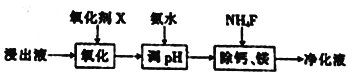
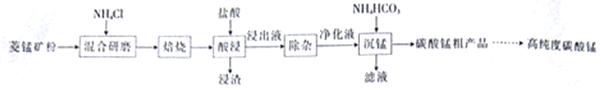
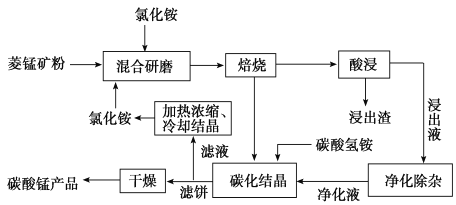
工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
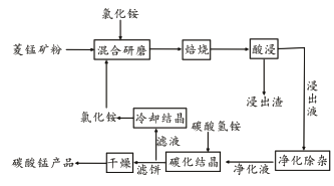
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3-
Fe3+
Ca2+
Mn2+
Mg2+
开始沉淀的pH值
4.1
2.2
10.6
8.8
9.6
沉淀完全的pH值
4.7
3.2
13.1
10.1
11.1
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
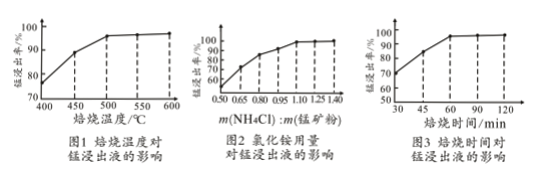
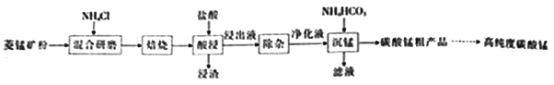
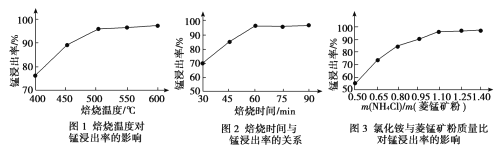
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+)。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
高三化学简答题困难题查看答案及解析
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰。已知:菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。焙烧后的产物用浓盐酸酸浸,再对浸出液净化除杂,得到的净化液加入碳酸氢铵溶液生成沉淀,洗涤干燥后即可得到产品。回答:
(1)焙烧过程中产生两种气体,一种可使湿润的蓝色石蕊试纸变红,另一种可使湿润的红色石蕊试纸变蓝。请写出焙烧过程中主要反应的方程式______________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,写出该反应的离子方程式______________________。检验Fe3+所用试剂的名称是__________。
(3)净化液加入碳酸氢铵溶液时反应的离子方程式为_____________________。
(4)上述生产过程中可循环使用的物质是________。
A.MnCO3 B. HCl C. NH4Cl D. 碳酸氢铵
(5)用滴定法测定浸出液中Mn2+的含量时,需向其中加入稍过量的磷酸和硝酸,加热会生成NO2-。加入稍过量的硫酸铵可以将其转化成无污染的物质而除去,该反应的离子方程式为________。
高三化学综合题中等难度题查看答案及解析
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
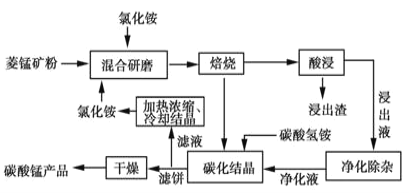
已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。
②部分阳离子沉淀时溶液的pH:
离子
Al3+
Fe3+
Ca2+
Mn2+
Mg2+
开始沉淀的pH
4.1
2.2
10.6
8.1
9.1
沉淀完全的pH
4.7
3.2
13.1
10.1
11.1
③焙烧过程中主要反应为MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合如图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
分别为___、___、___。
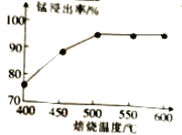
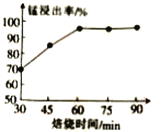
如图1焙烧温度对锰浸出率的影响
如图2焙烧时间与锰浸出率的关系
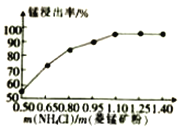
如图3氯化铵与菱锰矿粉质量比对锰浸出率的影响
(2)对浸出液净化除杂时,需先加入MnO2,作用是____,再调节溶液pH的范围为___,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)上述流程中可循环使用的物质是_____(填化学式)。
(4)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中的MnCO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+═N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用60.00mL0.50mol·L-1硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+═Mn2++Fe3++2PO43-,用5.00mL0.50mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_______。
②试样中锰的质量分数为____。
高三化学工业流程中等难度题查看答案及解析
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
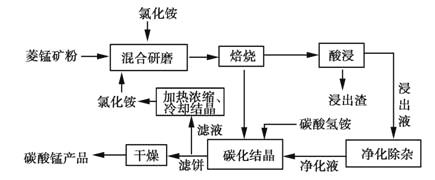
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
分别为_____、_____、_______。
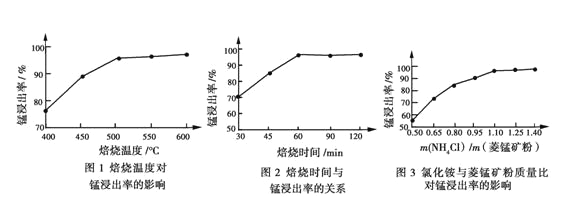
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_______,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______________。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++
+4
+2H+
2[Mn(PO4)2]3−+
+H2O充分进行;加入稍过量的硫酸铵,发生反应
+
N2↑+2H2O以除去
;加入稀硫酸酸化,用2.00 mol·L−1 10.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3−+Fe2+
Mn2++ Fe3++2
;用0.10 mol·L−110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________(还原产物是Cr3+)。
②试样中锰的质量分数为_______。
高三化学综合题中等难度题查看答案及解析
-
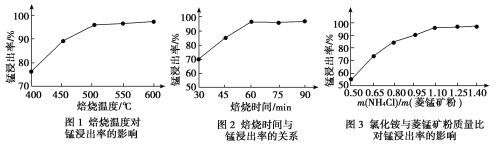
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
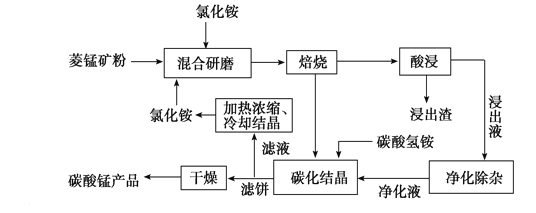
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
高三化学工业流程中等难度题查看答案及解析
-
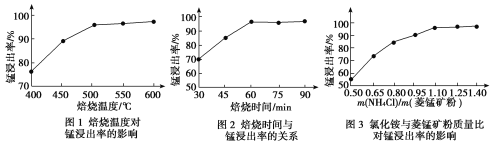
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
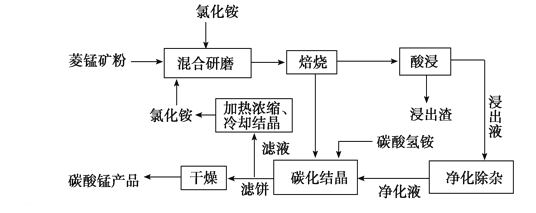
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
高三化学工业流程中等难度题查看答案及解析
-
工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
己知相关信息如下:
①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物
Mn(OH)2
MnCO3
CaF2
MgF2
Ksp
2.0×10-13
2.0×10-11
2.0×10-10
7.0×10-11
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为____、____、____。
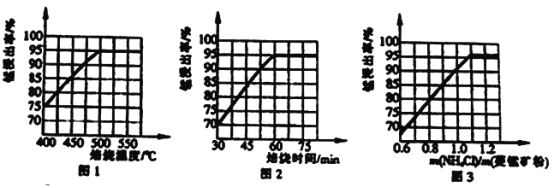
(2) “除杂”过程如下:
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2 >Cl 2>MnO2 >Fe2+,则氧化剂X宜选择_________(填字母)。
A. (NH4)2S2O3 B. MnO2 C. H2O2 D. Cl 2
②调节pH时,pH 可取的最低值为_____________。
③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c(Mg2+)=____mol/L。
(3)“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液,可能的原因是__________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL锥形瓶中,加少量水湿润,再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2 g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为[Mn(PO4)2]3-,多余的硝酸铵全部分解。用氮气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2-3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)Fe(SO4)2]标准溶液滴定,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=___________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或 “无影响”)。
高三化学综合题中等难度题查看答案及解析
-
工业上采用氨化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
已知相关信息如下:
①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应:MnCO3+2NH4C1
MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物
Mn(OH)2
MnCO3
CaF2
MgF2
Ksp
2.0×10-13
2.0×10-11
2.0×10-10
7.0×10-11
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、
 分别为_____、_____、_____、。
分别为_____、_____、_____、。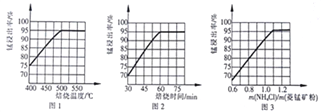
(2)“除杂“过程如下:
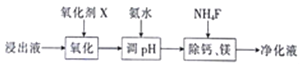
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择_______(填字母)。
A. (NH4)2S2O8 B.MnO2 C.H2O2 D. Cl2
②调节pH时,pH可取的最低值为________。
③当CaF2、MgF2 两种沉淀共存时,若溶液中c(Ca2+) =1.0×10-5mol/L,则c(Mg2+) =_____mol/L。
(3)“沉锰”过程中,不用碳酸钠溶液替代NH4HCO3溶液,可能的原因是____________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL作锥形瓶中,加少量水湿润。再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为Mn(PO4)2]3-,多余的硝酸铵全部分解。用氨气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定,发生的反应为:
[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3+ +2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或“无影响”)。
高三化学实验题中等难度题查看答案及解析
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
已知:
①菱锰矿的主要成分是
,其中含Fe、Ca、Mg、Al等元素。
②
、
沉淀完全的pH分别为
、
,
、
开始沉淀的pH分别为
、
。
焙烧过程中主要反应为
。
结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
分别为______、______、______。
对浸出液净化除杂时,需先加入
将
转化为
,再调节溶液pH的范围为______,将
和
变为沉淀而除去,然后加入
将
、
变为氟化物沉淀除去。
“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______。
上述流程中可循环使用的物质是______。
现用滴定法测定浸出液中
的含量。实验步骤:称取
g试样,向其中加入稍过量的磷酸和硝酸,加热使反应
 充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应
充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应以除去
;加入稀硫酸酸化,用
10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为
;用
10.00mL酸性
溶液恰好除去过量的
。
酸性
溶液与
反应
还原产物是
的离子方程式为______。
试样中锰的质量分数为______。
高三化学工业流程中等难度题查看答案及解析
-
碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
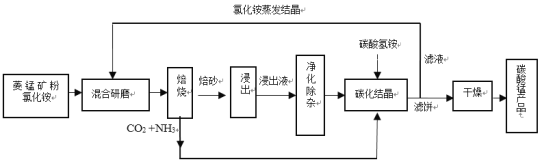
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol• L -1,形成M(OH)n沉淀的pH范围如下:
金属离子
Fe2+
Fe3+
Al3+
Mn2+
Mg2+
开始沉淀的pH
6.3
1.5
3.8
8.8
9.6
沉淀完全的pH
8.3
2.8
5.2
10.8
11.6
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol‧L-1时,c(Mg2+)=______mol‧L-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
)。重复操作3次,记录数据如下表:
滴定
次数
0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL)
滴定前
滴定后
1
0.10
10.20
2
0.22
11.32
3
1.05
10.95
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
高三化学工业流程中等难度题查看答案及解析