-
将纯水加热至较高温度,下列叙述正确的是
A、水的离子积变大,pH变小,呈酸性
B、水的离子积不变,pH不变,呈中性
C、水的离子积变小,pH变大,呈碱性
D、水的离子积变大,pH变小,呈中性
难度: 简单查看答案及解析
-
下列能用勒夏特列原理解释的是( )
A. 高温及加入催化剂都能使合成氨的反应速率加快
B. 红棕色的NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. H2、I2、HI平衡时的混合气体加压后颜色变深
难度: 简单查看答案及解析
-
下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+1/2O2(g)===H2O(g)ΔH1
B. C(s)+O2(g)===CO(g)ΔH2
C. S(s)+O2(g)===SO2(g)ΔH3
D. H2S(g)+1/2O2(g)===S(s)+H2O(l)ΔH4
难度: 中等查看答案及解析
-
下列推论正确的是
A. S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2
B. C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol.则含20gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7kJ
D. CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行
难度: 中等查看答案及解析
-
在一密闭容器中,加入物质A和B后发生反应aA(s)+bB(g)⇌cC(g),此反应是放热反应.关于化学反应速率的叙述正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 增加少量的A物质,正反应的化学反应速率加快
C. 增大压强,正反应速率加快,逆反应速率也加快
D. 达到平衡时消耗B的物质的量一定等于消耗C的物质的量
难度: 简单查看答案及解析
-
某温度下,BaSO4 饱和溶液中加少量的BaCl2 溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4 的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+ )>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
难度: 中等查看答案及解析
-
已知反应①CO(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
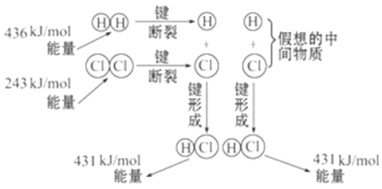
A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
难度: 中等查看答案及解析
-
符合如图所示的化学反应的热化学方程式是( )
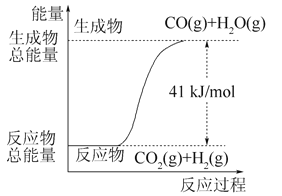
A. CO+H2O===CO2+H2ΔH=+41 kJ·mol-1
B. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
C. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1
D. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=-41 kJ·mol-1
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 增加C的量 B. 保持体积不变,充入H2 O使体系压强增大
C. 将容器的体积缩小一半 D. 保持压强不变,充入N2使容器体积增大
难度: 简单查看答案及解析
-
在一密闭容器中,aA(g)
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向正反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增大了 D. a>b
难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
A. 0.50mol/L B. 0.60mol/L C. 0.3mol/L D. 0.4mol/L
难度: 简单查看答案及解析
-
密闭容器中进行的可逆反应:aA(g)+bB(g)
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
难度: 困难查看答案及解析
-
常温下,用 0.1000molL﹣1NaOH溶液滴定 20.00mL0.1000molL﹣1CH3COOH溶液所得滴定曲线如图.下列说法正确的是
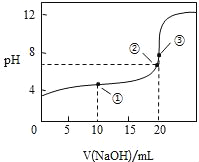
A. 点①所示溶液中:c(CH3COO﹣)+c(OH﹣)=c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO﹣)
C. 点③所示溶液中:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)
难度: 中等查看答案及解析