-
下列有关物质的分类或归纳的说法正确的是( )
A. 漂白粉、水玻璃、福尔马林都是混合物
B. 乙烯、油脂、纤维素、光导纤维都属于高分子化合物
C. PM2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶,能产生丁达尔效应
D. 纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
难度: 简单查看答案及解析
-
化学与社会、生活密切相关。下列有关说法错误的是( )
A. 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境
B. 臭氧的还原性使细菌的蛋白质变性
C. “地沟油”经过加工处理后可用来制肥皂
D. 光化学烟雾是碳氢化合物和氮氧化合物在太阳光(紫外线)作用下发生光化学反应生成的二次污染物
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. H2S的电子式:
B. 对硝基甲苯:
C. 氧离子的结构示意图:
D. 质子数为53,中子数为74的碘原子:
I
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1NA
B. 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3NA
C. 标准状况下,2.24 L Cl2溶于足量的水中充分反应后,溶液中Cl-数为0.2NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3NA
难度: 中等查看答案及解析
-
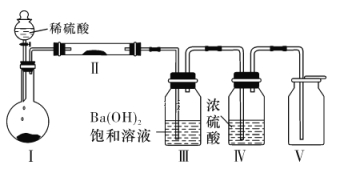
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧后得到Al2O3,下列图示装置和原理均合理的是( )
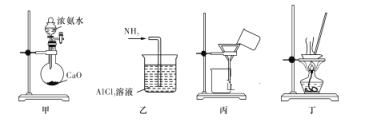
A. 用装置甲制取 NH3
B. 用装置乙制备 Al(OH)3
C. 用装置丙过滤并洗涤 Al(OH)3
D. 用装置丁灼烧 Al(OH)3得到Al2O3
难度: 简单查看答案及解析
-
下列实验操作或结论正确的是( )
A. 配制溶液的操作中,向容量瓶中转移溶液后,玻璃棒、烧杯未洗涤会使得所配溶液浓度偏高
B. 洗涤沉淀的操作是在过滤器中边用玻璃棒搅拌边加蒸馏水冲洗沉淀物
C. 实验室配制950 mL 0.2 mol/L的CuSO4溶液时,需称取胆矾的质量为50.0 g
D. 制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
难度: 中等查看答案及解析
-
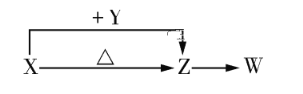
短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
难度: 中等查看答案及解析
-
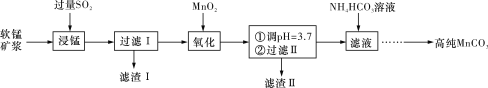
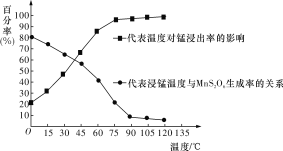
重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
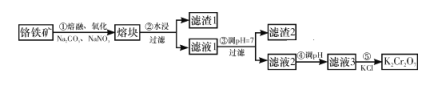
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
难度: 中等查看答案及解析
-
最新发现的第113号、115号、117号和118号元素已正式写入元素周期表。根据物质结构、元素周期律的知识,下列说法正确的是( )
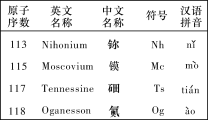
A. Nh(OH)3具有两性
B. Mc位于元素周期表中第七周期第ⅤA族,其原子半径小于Ts
C. Og是一种人工合成的稀有气体元素,在元素周期表中位于第七周期0族
D. 若制得Ts的最高价氧化物对应的水化物,其酸性强于HClO4
难度: 中等查看答案及解析
-
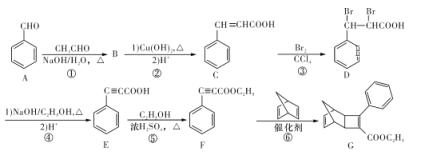
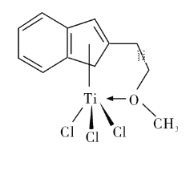
一种合成某药物中间体Z的方法如下,下列说法正确的是( )
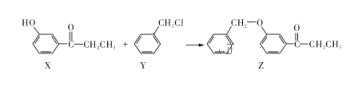
A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
难度: 中等查看答案及解析
-
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
难度: 中等查看答案及解析
-
现有氧化还原反应:①2Br-+ Cl2===Br2+2Cl-;②2Fe2++Br2===2Fe3++2Br-;③2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O。根据上述反应,判断下列结论正确的是( )
A. 还原性强弱顺序为Fe2+>Br->Mn2+>Cl-
B. 反应①中Cl-是Cl2的氧化产物,反应③中Cl2是 Cl- 的还原产物
C. 若向酸性KMnO4溶液中加入FeSO4溶液,可观察到溶液紫红色褪去
D. 1 mol Cl2通入含1 mol FeBr2的溶液中,离子反应为3Cl2+2Fe2++4Br-===2Br2+6Cl-+2Fe3+
难度: 困难查看答案及解析
-
氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L。对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化。发生的反应为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O。下列有关说法不正确的是( )
A. 上述反应中氧化产物有N2和CO2
B. 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离
C. 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D. 现取1 L含CN-1.02 mg/L的废水,至少需用5.0×10-5 mol Cl2处理后才符合排放标准
难度: 困难查看答案及解析