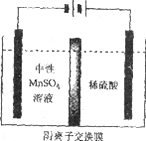
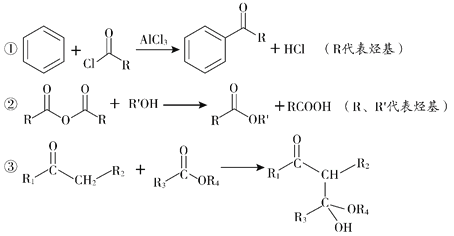
-
下列物质的用途利用了其氧化性的是( )
A. 漂粉精用于消毒游泳池水 B. SO2用于漂白纸浆
C. Na2S用于除去废水中的Hg2+ D. FeCl2溶液用于吸收Cl2
难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层8电子结构的是
A. BF3 B. NCl3 C. H2O D. PCl5
难度: 中等查看答案及解析
-
下列事实中,不能用元素周期律解释的是
A. 原子半径:K> Ca> Mg B. 碱性:NaOH> Mg(OH)2>Al(OH)3
C. 热稳定性:HF> HCl> H2S D. 酸性:H2SO3> H2CO3> H2SiO3
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol OH- 中含有9NA个电子
B. 28 g的CO气体中含有NA个氧原子
C. 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+
D. 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列离子或分子能够在指定的分散系中大量共存的是
A. 空气中:CO2、NO、N2、NH3
B. 明矾溶液中:H+、Mg2+、Na+、Cl-
C. 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+
D. 常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Na+、Cl-、CO32-
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 铜丝溶于浓硝酸生成绿色溶液:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
B. 稀硫酸与Ba(OH)2溶液混合出现浑浊:H++OH-+ Ba2++SO42- =BaSO4↓+H2O
C. 澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O
D. 在A1C13溶液中加入过量氨水出现浑浊:A13++3OH-= Al(OH)3↓
难度: 中等查看答案及解析
-
下列我国古代的技术应用中,不涉及氧化还原反应的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
NH4++OH−
C. 由Na和C1形成离子键的过程:

D. 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
难度: 中等查看答案及解析
-
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如下图所示。
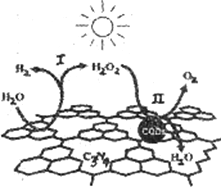
下列说法不正确的是
A. 该催化反应实现了太阳能向化学能的转化
B. 阶段I中,H2O2是氧化产物
C. 每生成1molO2,阶段II中转移电子2 mol
D. 反应的两个阶段均为吸热过程
难度: 中等查看答案及解析
-
中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
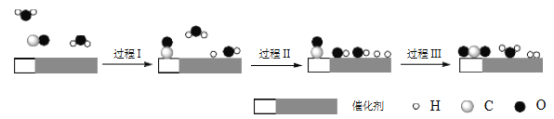
下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
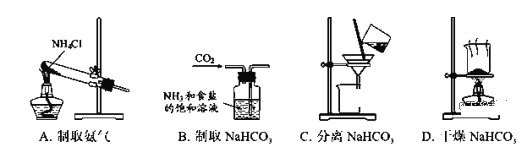
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32—(aq)
PbCO3(s) + SO42—(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
D. 整个过程涉及一个复分解反应和两个氧化还原反应
难度: 困难查看答案及解析
-
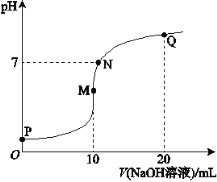
室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质
结论
A
100 mL0.1 mol/L盐酸
溶液中2c(NH4+)= c(Cl-)
B
0.01 mol Na2O2固体
反应完全后,溶液pH增大,c(Na+)= 2c(Cl-)
C
100 mL H2O
由水电离出的c(H+)·c(OH-)变大(均自由离子)
D
100 mL 0.1 mol/L氨水
溶液中
减小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
O2(g) +H2(g) =H2O(g)
H=-242kJ·mol-1
S(g)+ H2(g) =H2S(g)
H=-20kJ·mol-1
Se(g)+H2(g)
H2Se(g)
H=+81kJ·mol-1
下列说法正确的是
A. 稳定性:H2O< H2S< H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g)+2H2S(g)=2H2O(g)+2S(g)
H=-444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
难度: 中等查看答案及解析
-
松香中含有松香酸和海松酸,其结构简式如下图所示。下列说法中,不正确的是
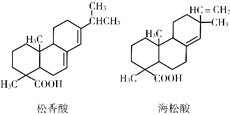
A. 二者互为同分异构体
B. 二者所含官能团的种类和数目相同
C. 二者均能与氢氧化钠溶液反应
D. 二者均能与H2以物质的量之比为1∶3发生反应
难度: 中等查看答案及解析
-
某实验小组通过下图所示实验探究Na2O2与水的反应:

下列说法不正确的是
A. ②中的大量气泡主要成分是氧气
B. ③中溶液变红,说明有碱性物质生成
C. ④中现象可能是由于溶液中含有强氧化性物质造成的
D. ⑤中MnO2的主要作用是降低了水中氧气的溶解度
难度: 中等查看答案及解析
-
工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
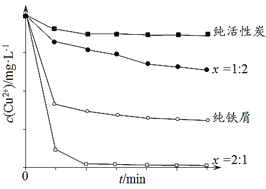
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
难度: 中等查看答案及解析
-
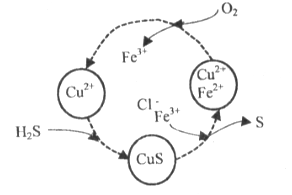
某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是
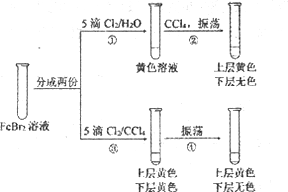
A. 操作④中发生的反应是Br2+ 2Fe2+=2Br-+2Fe3+
B. 操作②和操作④之后,试管上层溶液的成分相同
C. 操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D. 实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
难度: 中等查看答案及解析
-
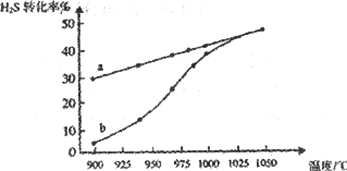
一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s
0
1
2
3
4
c(SO2)/mol·L-1
1.00
0.50
0.23
3.00×10-37
3.00×10-37
c(CO)/mol·L-1
4.00
3.00
2.46
2.00
2.00
下列说法不正确的是
A. X的化学式为CO2
B. 前1s内v(X)=" 1.00" mol·L-1·s-1
C. 该回收原理运用了SO2的还原性
D. 该温度下,此反应的平衡常数的数值是3.33×1036
难度: 中等查看答案及解析
-
实验:①0.005 mol·L-1 FeCl3溶液和0.015 mol·L-1 KSCN溶液各1mL混合得到红色溶a,均分溶液a置于b、c两支试管中;②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;③再向上述b溶液中滴加3滴1 mol·L-1 NaOH溶液,溶液颜色变浅且出现浑浊;④向c中逐渐滴加1mol·L-1 KSCN溶液2 mL,溶液颜色先变深后变浅。下列分析不正确的是
A. 实验②中增大Fe3+浓度使平衡Fe3++ 3SCN-
Fe(SCN)3正向移动
B. 实验③中发生反应:Fe3++3OH-=Fe(OH)3↓
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
难度: 中等查看答案及解析