-
下列有机物的命名正确的是( )
A. 3,3-二甲基丁烷 B.3-甲基-2-丁烯
C. 2-乙基丁烷 D.
名称为1,4-二甲苯
难度: 简单查看答案及解析
-
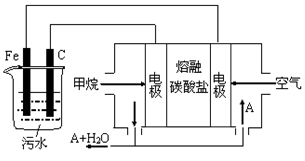
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
难度: 简单查看答案及解析
-
下列推论正确的是
A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b
B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的稀溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ
D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行
难度: 简单查看答案及解析
-
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率
难度: 简单查看答案及解析
-
在恒容密闭容器中A(g)+3B(g)
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
A.容器中混合气体的平均相对分子质量增大
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正反应速率和逆反应速率都变小,C的百分含量增加
D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据
难度: 简单查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则
m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
难度: 简单查看答案及解析
-
下列关于电解质溶液的叙述中正确的是
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH
)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
难度: 简单查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32—)
C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S)
难度: 简单查看答案及解析
-
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g某金属,下列说法正确的是
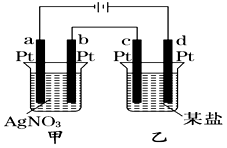
A.甲池b极上析出金属银,乙池c极上析出某金属
B.甲池a极上析出金属银,乙池d极上析出某金属
C.某盐溶液可能是CuSO4溶液 D.某盐溶液可能是Mg(NO3)2溶液
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④HF与水能以任意比混溶
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥常温下0.1mol/L的HF溶液的pH为2.3
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①⑥ B.①②⑦ C.③④⑥ D. ②③⑤
难度: 简单查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,又用标准溶液润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
难度: 简单查看答案及解析
-
25℃时,在水电离出的C(H+)=1×10-12摩/升的溶液中,一定能大量共存的是 ( )
A.Al3+、NH4+、SO42-、Cl- B. Mg2+、K+、SO42-、HCO3-
C.K+、Na+、Cl-、SO42- D.K +、Cl-、Na+、PO43-
难度: 简单查看答案及解析
-
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g)
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
A.20% B.40%C.60% D.80%
难度: 简单查看答案及解析
-
25℃时,若体积Va、PH=a的某一元强酸溶液与体积Vb、pH=b的某一元强碱溶液混合,恰好中和,且已知Va<Vb,a=0.5b,a的取值范围是( )
A.7/2<a<14/3 B.7<a<14 C.3<a<5 D.9/2<a<15/2
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是 ( )
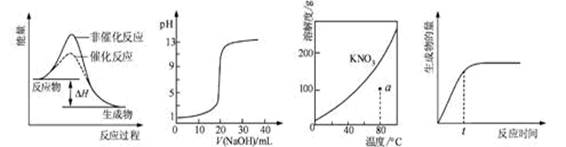
图1 图2 图3 图4
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆
难度: 简单查看答案及解析
-
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 = 2 CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是
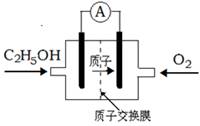
A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是负极
C.该电池的正极反应为:4H+ + O2 + 4
= 2H2O
D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L
难度: 简单查看答案及解析