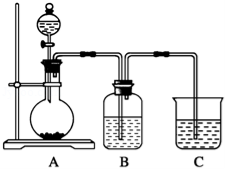
-
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化
B. 元素相对原子质量依次递增
C. 元素原子最外层电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
下列结论正确的是( )
①粒子半径:K+>Al3+>S2﹣>Cl﹣
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2﹣>Cl﹣>Br﹣>I﹣
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
A. ②⑤⑦ B. ②④⑥ C. ②④⑤⑥⑦ D. ②⑥⑦
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼非金属元素
C. 若Y的最低化合价为﹣2,则Z的最高正化合价为+6
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
难度: 中等查看答案及解析
-
168O、188O、O2﹣、O2、O3是( )
A. 氧元素的五种不同微粒
B. 五种氧元素
C. 氧的五种同素异形体
D. 氧的五种同位素
难度: 简单查看答案及解析
-
下列元素均位于第ⅦA族,其中非金属性最强的元素是( )
A. F B. Cl C. Br D. I
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A. 稀有气体元素
B. 左、下方区域的金属元素
C. 右、上方区域的非金属元素
D. 金属元素和非金属元素分界线附近的元素
难度: 中等查看答案及解析
-
下列各组性质的比较中正确的是( )
A. 酸性HClO4<HBrO4<HIO4
B. 碱性Ba(OH)2>Ca(OH)2>Mg(OH)2
C. 稳定性HCl>PH3>H2S
D. 还原性Cl﹣>Br﹣>I﹣
难度: 中等查看答案及解析
-
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( )
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列叙述正确的是( )
A. 由于相对分子质量:HCl>HF,故沸点:HCl>HF
B. 由于氮元素的最低化合价只有﹣3价,故NH5这种物质不可能存在
C. 硅处于金属与非金属的过渡位置,硅可用作半导体材料
D. Cl﹣、S2﹣、Ca2+、K+半径逐渐减小
难度: 中等查看答案及解析
-
下列粒子的结构示意图中,表示氯离子的是( )
A.
B.
C.
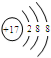 D.
D. 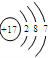
难度: 简单查看答案及解析
-
下列元素中,属于第ⅥA族的是( )
A. Mg B. Al C. Si D. S
难度: 简单查看答案及解析
-
主族元素在周期表中的位置取决于元素原子的( )
A. 原子量和核外电子数
B. 电子层数和最外层电子数
C. 原子量和最外层电子数
D. 电子层数和次外层电子数
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是( )
A. 18个纵横代表18个族,7个主族、8个副族
B. 短周期共有32种元素
C. 元素周期表共有七个横行代表七个周期
D. 第IA族全部是金属元素
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 两种不同元素的原子中,137Cs比131I多6个中子
B. 多电子原子中,在离核较远的区域内运动的电子能量较低
C. 同主族元素的简单阴离子还原性越强,其氢化物的稳定性越强
D. 短周期元素X和Y的原子序数相差2,则X与Y可能同周期,也可能同主族
难度: 中等查看答案及解析
-
核中中子数为N的R2﹣,质量数为A,则该离子的核外电子数为( )
A. A﹣N﹣2 B. A﹣N+2 C. A+N﹣2 D. A+N+2
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M4均为直线形的共价化合物
C. W2Z2是既含离子键又含共价键的离子化合物
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键
难度: 困难查看答案及解析
-
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论.因此,推出的结论最终要经过实践的检验才能决定其是否正确.以下几种类推结论中,正确的是( )
A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C.Fe3O4可以写成FeO3;Pb3O4也可以写成PbO•Pb2O3
D.NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性
难度: 困难查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质.下列预测中正确的是( )
①Be的氧化物的水化物可能具有两性
②第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
A. ①②③④ B. ②④⑥ C. ①③⑤ D. ②④⑤
难度: 中等查看答案及解析
-
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下不正确的是( )
元素性质
元素编号
①
②
③
④
⑤
⑥
⑦
原子半径(nm)
0.073
0.075
0.152
0.110
0.099
0.186
0.143
最高正化合价
无
+5
+1
+5
+7
+1
+3
最低负化合价
﹣2
﹣3
无
﹣3
﹣1
无
无
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
A. 元素A所形成的氧化物只有一种
B. 元素B的最高价氧化物对应的水化物为强酸
C. 元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D. 氢化物的稳定性:A>B
难度: 困难查看答案及解析
-
下列物质属于离子化合物且含有共价键的是( )
A.KOH B.MgCl2 C.HCl D.N2
难度: 中等查看答案及解析
-
下列电子式书写正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCI、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
难度: 中等查看答案及解析
-
下列物质中既有离子键又有共价键的是( )
A.CaCl2 B.H2O C.K2O D.NaOH
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是( )
A.离子化合物中一定存在离子键,可能存在共价键
B.由金属元素和非金属元素组的化学键一定是离子键
C.非极性键只存在于双原子单质分子中
D.NH4Cl是一种共价化合物
难度: 中等查看答案及解析
-
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子.则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M B.X>Z>M>Y
C.M>Z>X>Y D.X>Z>Y>M
难度: 中等查看答案及解析
-
关于锌铜﹣稀硫酸原电池的叙述,错误的是( )
A.氢离子在铜表面被还原,产生气泡
B.电流从锌片经导线流向铜片
C.电子从锌片经导线流向铜片
D.锌是负极,其质量逐渐减小
难度: 中等查看答案及解析
-
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH﹣﹣2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH﹣,根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag20极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
难度: 中等查看答案及解析
-
图中能组成原电池产生电流的是( )
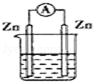
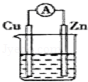
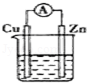
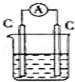
A.稀H2SO4 B.稀H2SO4 C.酒精 D.ZnSO4
难度: 中等查看答案及解析
-
标准状态下,气态分子断开l mol化学键的焓变称为键能.已知H﹣H、H﹣O和O═O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol.下列热化学方程式正确的是( )
A.H2O (g)═H2(g)+
O2(g);△H═﹣485 kJ/mol
B.2H2(g)+O2(g)═2H2O(g);△H═﹣485 kJ/mol
C.2H2(g)+O2 (g)═2H2O(g);△H═+485 kJ/mol
D.H2O (g)═H2(g)+
O2(g);△H═+485 kJ/mol
难度: 中等查看答案及解析