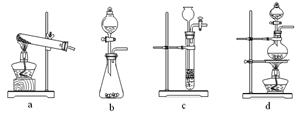
-
下列说法正确的是
A.苯能使酸性KMnO4溶液褪色 B.汽油、柴油和植物油都是碳氢化合物
C.乙酸和油脂都能与氢氧化钠溶液反应 D.苯在工业上主要是通过石油分馏得到
难度: 中等查看答案及解析
-
已知A、B、C是单质,其中C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略),下列判断不正确的是
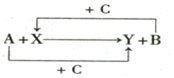
A.A 是铝,B是铁 B.A 是碳,B是硅
C.A 是氢气,B是铜 D.A 是钠,B是氢气
难度: 中等查看答案及解析
-
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳 离子浓度随溶液
的变化如图所示。下列判断正确的是
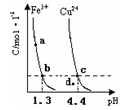
A.加适量浓NH3·H2O可使溶液由
点变到
点
B.
两点代表的溶液中
与
乘积不相等
C.Cu(OH)2在
点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的
难度: 中等查看答案及解析
-
已知A、B、C、D、E分别为Ca(OH)2、Ca (HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中 的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
A.HCl B.Ca(HCO3)2 C.Na2CO3 D.Ba(NO3)2
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、 Y、Z、W同周期, Z、M同主族; X+ 与M2-具有相同的电子层结构;离子半径:Z2-
>W-;Y的单质晶体熔点高、硬度大,是一 种重要的半导体材料。下列说法正确的是
A.X、M两种元素只能形成X2M型化合物
B.Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定
C.Z、W两元素的最高价氧化物对应水化物的酸性:Z > W
D.W、M两元素的某些单质或化合物可作为自来水消毒剂
难度: 中等查看答案及解析
-
根据下列化学实验示意图及表中实验现象,能得出正确结论的是
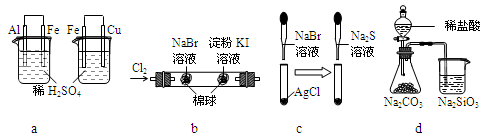
选项
实验
实验现象
结论
A
a
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡
活动性:Al>Fe>Cu
B
b
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
c
白色固体先变为淡黄色,后变为黑色
溶解性:AgCl < AgBr< Ag2S
D
d
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
难度: 中等查看答案及解析
-
第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,
电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意,其总反应式为:
 ,下列说法中正确的是
,下列说法中正确的是
A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动
B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大
C.混合动力车上坡或加速时,乙电极电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-
D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O
难度: 中等查看答案及解析
-
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
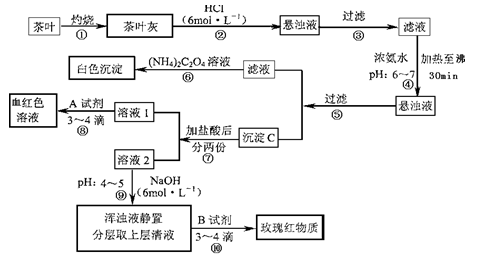
【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是________。
(2)步骤③操作中用到的玻璃仪器有________。
(3)写出步骤⑥中检验Ca2+存在的离子方程式________。
(4)写出沉淀C所含主要物质的化学式。
(5)写出步骤⑧中选用A试剂的化学式________。
(6)步骤⑨的作用是________,
猜测步骤⑩的目的是________。
难度: 中等查看答案及解析
-
(14分)火力发电厂释放出大量的氮氧化物(NOx).二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝.脱碳和脱硫等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为:________。
2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g);ΔH3
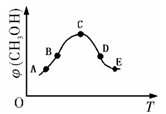
① 取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3,分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,根据图示 ________(填写具体的线段)走向,则上述CO2转化为甲醇的反应的ΔH3 ________0(填“>”.“<”或“=”)。
② 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 ________ (填字母代号)。
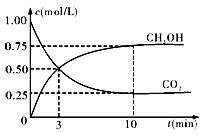
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH) > 1.5mol·L-1 且化学平衡常数K值增大。
B.0~10min内,氢气的平均反应速率为0.075mol•(L·min)-1
C.达到平衡时,氢气的转化率为75 %
D.第10min后,升高温度将使n(CH3OH)/n(CO2)减小
(3)脱硫。燃煤废气经脱碳处理后,用空气氧化,并用氨气吸收生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为:________ 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其原因可用一个离子方程式表示为: ________ ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中存在着离子浓度关系为:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
难度: 中等查看答案及解析
-
(13分)
(1)A、B、C为短周期元素,请根据下表信息回答问题。
元素
A
B
C
性质或结构信息
工业上通过分离液态空气获得其单质,单质能助燃
气态氢化物的水溶液显碱性
原子有三个电子层,简单离子在本周期中半径最小
① 第一电离能:A________B(填“>”、“<”或“=”), 基态C原子的电子排布式为________。
② B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为________。
(2)发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效
催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化。
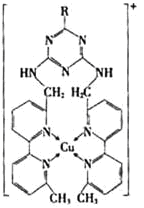
① 某含铜的离子结构如图所示:
在该离子内部微粒间作用力的类型有________。
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键) (填字母)
② 煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键。请你说明甲醛分子间没有氢键原因________;
③ 甲醇分子中进行sp3杂化的原子有;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为________。
难度: 中等查看答案及解析
-
(13分)有机化合物A~F的相互转化关系如下图所示(图中副产物均未写出):
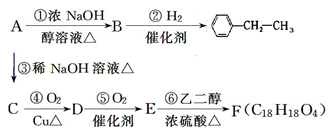
其中A的相对分子质量比
大36.5,请回答:
(1) 按下列要求填写:
A的结构简式______________;E中含氧官能团的名称_________________。
(2) 写出反应⑥的化学反应类型:________________________________。
(3) 写出反应④的化学方程式:____________________________________________。
(4) B分子内处于同一平面上的原子最多有________个,B在一定条件下可以发生加成
聚合反应生成高分子化合物N,则N的结构简式为_________________。
(5) 化合物M是E的一种同分异构体,M具有如下性质:①不与NaHCO3反应,②遇FeCl3溶液显紫色,③1 mol M恰好与2 mol NaOH反应,则M的结构简式为________(写一种)。
难度: 中等查看答案及解析