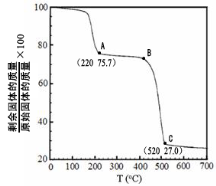
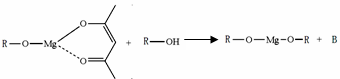
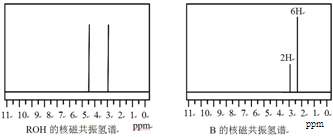
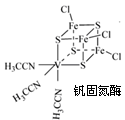
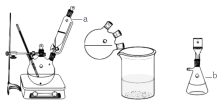
-
2013年10月世界卫生组织癌症专门机构首次指认大气污染“对人类致癌”。下列行为有利于防止大气污染、遏制雾霾天气发生的是
A.在田间焚烧秸杆
B.冬季燃烧大量烟煤供热取暖
C.提倡开私家车出行,减少乘坐公交车
D.改善能源结构,大力发展太阳能、风能等清洁能源
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.乙醇的结构简式 C2H6O
B.氨基的电子式
C.镁离子的结构示意图
D.中子数为79、质子数为55 的铯(Cs)原子
Cs
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3-
B.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C.0.1 mol·L-1氨水溶液:K+、Na+、NO3-、AlO2-
D.由水电离出的c(H+)=10-11mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列有关物质性质的应用正确的是
A.氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B.碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C.氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D.铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA
B.标准状况下,2.24L氯气中含有的
Cl数目一定为0.2NA
C.常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA
D.80mL 10mol·L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA
难度: 中等查看答案及解析
-
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有
序号
X
Y
Z
W
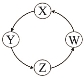
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A.①②③ B.①③④ C.②③ D.①④
难度: 中等查看答案及解析
-
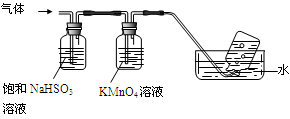
下列装置或操作能达到实验目的的是
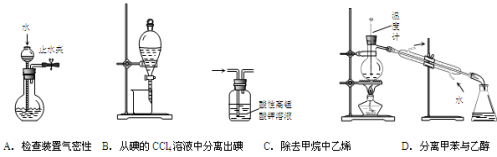
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.氯气通入水中:Cl2 + H2O
2H+ + Cl-+ClO-
B.氢氧化铁胶体中加入HI溶液:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32-
D.用稀硝酸除去试管内壁银:3Ag+ 4H+ + NO3- = 3Ag+ + NO↑ +2H2O
难度: 中等查看答案及解析
-
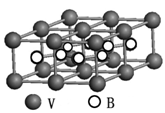
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是
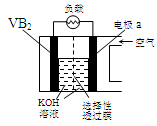
A.电极a为电池负极
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经KOH溶液流向a电极
D.VB2极发生的电极反应为:
2VB2 + 22OH−- 22e−→V2O5 + 2B2O3 + 11H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是
A.原子半径: r(Y)> r (Z)> r (W)
B.Y、Z、W的简单离子的电子层结构相同
C.XWm与YWn中化学键类型相同(m、n为正整数)
D.元素Z 的简单气态氢化物的热稳定性比W 的强
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.反应SiO2(s)+ 3C(s) = SiC(s) + 2CO(g)室温下不能自发进行,则该反应的△H<0
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.25℃下,在NH3·H2O稀溶液中,加水,
的值不变
D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大
难度: 困难查看答案及解析
-
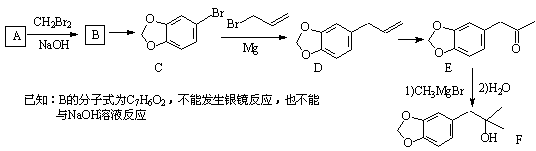
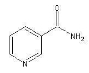
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是
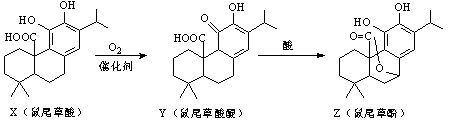
A.X、Y、Z互为同分异构体
B.X、Z均能与FeCl3溶液发生显色反应
C.X、Y、Z分子中均含有2个手性碳原子
D.1molX与NaOH溶液反应最多消耗3molNaOH
难度: 中等查看答案及解析
-
下表中根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水
石灰水变浑浊
W可能是Na2CO3
B
蘸有浓氨水的玻璃棒靠近溶液X
有白烟产生
X一定是浓盐酸
C
强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液
先有白色沉淀,
后溶液又变红
Y中一定含有SO42-和Fe3+
D
少量气态炔烃Z通入pH=a的溴水中
溴水褪色,溶液的pH仍约为a
Z与溴发生了取代反应
难度: 中等查看答案及解析
-
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
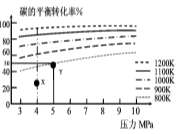
A.上述正反应为吸热反应
B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆
C.在5MPa、800K时,该反应的平衡常数为
L2·mol-2
D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因
为前者碳的转化率高
难度: 中等查看答案及解析
-
一定温度下,将0.1molAgCl加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是
A.沉淀转化反应2AgCl(s)+ CO32-(aq)
Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B.约有2×10-5mol AgCl溶解
C.反应后溶液中的:c(Na+)>c (Cl-) >c (CO32-) >c (OH-) >c (H+)
D.反应后溶液中的:c(Na+)+ c (H+)+ c (Ag+)=2 c (CO32-)+ c (HCO3-)+ c (Cl-)+ c (OH-)
难度: 中等查看答案及解析