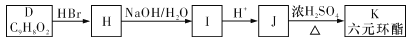
-
下列有关化学知识的描述错误的是
A. “水滴石穿,绳锯木断”中不包含化学变化
B. 福尔马林、漂白粉、碱石灰均为混合物
C. 生石灰能与SO2反应,可用作工业废气的脱硫剂
D. 聚丙烯酸钠树脂是一种高吸水性的高分子化合物
难度: 中等查看答案及解析
-
下列有关NA的叙述正确的是
A. 常温常压下,1 mol苯中含有的碳碳双键数目为3NA
B. 25℃时,pH=11的氨水中含有的OH-数目为0.001NA
C. 标准状况下,22.4 LHCl中含有的电子数目为18NA
D. 64 9 SO2与足量的氧气反应,生成的SO3数目为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Cl2通入水中: Cl2+H2O=2H++Cl-+ClO-
B. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
C. 明矾溶于水产生Al(OH)3胶体:A13++3H2O=Al(OH)3↓+3H+
D. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+ H2O
难度: 中等查看答案及解析
-
下列叙述正确的是
A

两个有机反应的反应类型都是加成反应
B
H2O+2SO2 +CO32-=CO2 +2HSO3-
H2O+CO2 +SiO32-=H2CO3↓ +CO32-
由这两个反应不能得出非金属性:S> C> Si
C
2F2+2H2O=4HF+O2 2Na2O2+2H2O=4NaOH+O2↑
两个反应中的H2O均被氧化
D
NH4++H2O
NH3·H2O + H+
H2PO4-+H2O
HPPO42-+H3O+
两个离子方程式均为水解方程式
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
从煤焦油中分离出的芳香烃——萘(
)是一种重要的化工原料,萘环上一个氢原子被丁基(-C4H9)所取代的同分异构体(不考虑立体异构)有
A. 2种 B. 4种 C. 8种 D. 16种
难度: 中等查看答案及解析
-
乙酸异丁香酚酯主要用于配制树莓、草莓、浆果和混合香辛料等香精。其结构简式如下图所示,下列说法正确的是
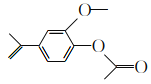
A. 异丁香酚的分子式是C10H12O2,分子中含有含氧官能团羟基和醚键
B. 乙酸异丁香酚酯中的所有碳原子不可能在一个平面内
C. 乙酸异丁香酚酯能与溴水发生加成反应和取代反应
D. 1 mol乙酸异丁香酚酯最多能与1 mol NaOH发生反应
难度: 中等查看答案及解析
-
无机物X、Y、Z、M的相互转化关系如图所示(部分反应条件、部分反应中的H.,O已略去)。X、Y、Z均含有同一种元素。下列说法正确的是
A. 若X是氢氧化钠,则M不一定为CO2
B. 若Y具有两性,则M的溶液只可能显碱性
C. 若Z是导致酸雨的主要气体,则X一定是H2S
D. 若M是用途最广的金属,加热蒸干Y的溶液一定能得到Y
难度: 困难查看答案及解析
-
已知:H-H键、O=O键和O-H键的键能分别为436 kJ/mol、496 kJj/mol和462kJ/mol;2C(s)+O2 (g)=2CO(g) ∆H=-220 kJ/mol ;C(s)+H2O(g)=CO(g)+H2 (g) ∆H=a kJ/mol。则a为
A. -332 B. -118 C. +130 D. +350
难度: 中等查看答案及解析
-
下列实验误差分析正确的是
A. 用容量瓶配制溶液时,容量瓶底部有少量蒸馏水,所配溶液浓度偏低
B. 酸碱中和滴定时,开始时俯视滴定管读数,结束时仰视滴定管读数,所测液体体积偏大
C. 测定中和热时,使用稀醋酸代替稀盐酸,所测中和热无影响
D. 测定硫酸铜晶体中结晶水含量时,被测样品中含有加热不挥发杂质,所测结晶水含量偏高
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应xM (g)+yN(g)
zP(g)。平衡时测得M的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0. 30 mol/L。下列有关判断正确的是
A. x+y<z B. 平衡向正反应方向移动
C. N的转化率降低 D. 混合气体的密度不变
难度: 困难查看答案及解析
-
某温度下,向10mL0.1 mol/L的醋醵溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc (OH-)]的变化关系如图所示。则下列说法正确的是
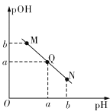
A. 两者恰好反应完全,需要NaOH溶液的体积大于10mL
B. Q点时溶液的pH=7
C. M点时溶液呈碱性,对水的电离起抑制作用
D. N点所示溶液中,c(CH3COO-)>c(CH3COOH)
难度: 困难查看答案及解析
-
将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
难度: 困难查看答案及解析
-
利用氯碱工业的产品处理含SC/的烟气的流程如下图所示。下列说法错误的是

A. 向NaHSO3溶液中加入少量I2,C(H2SO3)/C(HSO3-)将减小
B. 氯碱工业的产品可以用于生产漂白粉
C. 回收装置中发生的离子反应为HSO3-+H+=SO2↑+H2O
D. 上述流程中可循环利用的物质是NaCl
难度: 中等查看答案及解析
-
利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项
①中试剂
②中试剂
结论

A
镁条、蒸馏水
肥皂水
②中开始出现气泡,说明①中生成了氢气
B
铜片、硝酸溶液
蒸馏水
②中试管口出现红棕色气体,说明①中生成了NO2
C
二氧化锰、浓盐酸
淀粉KI溶液
该装置可以用来检验①中是否产生了氯气
D
乙醇、乙酸、浓硫酸
饱和NaOH溶液
该装置可以用来制备乙酸乙酯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
室温下,下列有关溶液中微粒的物质的量浓度的关系正确的是
A. 0.1mol/L NH4 Cl溶液与0.1 mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(C1-)>c(OH-)>c(H+)
B. 0.1 mol/LCH3 COONa溶液与0.1 mol/L盐酸等体积混合:c(OH-)<c(CH3COO-)< c(H+)< c(C1-)=o.1 mol/L
C. 0.1mol/LNa2CO3溶液与0.1 mol/L盐酸等体积混合:2c(CO32-)+C(HCO3-)+ c(OH-)=c(Na+)+c(H+)
D. 0.1 mol/LNaHS溶液与0.2 mol/LNaOH溶液等体积混合:c(OH-)-c(H+) =C(S2-)+ 2c(HS-)+ 3c(H2S)
难度: 困难查看答案及解析
-
常温下向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为
A. NaHCO3、Na2CO3 B. NaOH、NaHCO3 C. NaOH、Na2CO3 D. NaOH、Na2CO3、NaHCO3
难度: 困难查看答案及解析
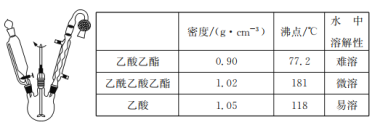


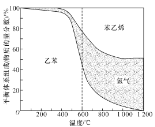
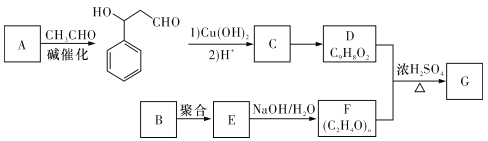
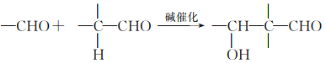 ;
;