-
人类的文明和科学技术的发展,对能源的需求不断增大,而天然气、石油、煤等在地球上的蕴藏量很有限,因此使用和开发新能源成为当前国际能源研究的重要课题.下列提供的途径中正确的是( )
①利用电解水的方法得到氢气作能源
②用以高粱、玉米等为原料制得的乙醇作能源
③砍伐大量树木作能源
④开发太阳能、核能等新的能源.
A.①②
B.①②④
C.②和④
D.①②③④难度: 中等查看答案及解析
-
一定条件下,1g碳与适量水蒸气完全反应生成一氧化碳和氢气,需吸收10.94kJ的热量.则下列热化学方程式正确的是( )
A.C+H2O=CO+H2△H=+10.94kJ•mol-1
B.C(s)+H2O(g)=CO(g)+H2(g)△H=+10.94 kJ•mol-1
C.C(s)+H2O(g)=CO(g)+H2(g)△H=-131.3 kJ•mol-1
D.C(s)+
H2O(g)=
CO(g)+
H2(g)△H=+65.64 kJ•mol-1
难度: 中等查看答案及解析
-
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
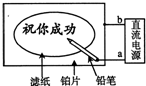
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.用托盘天平称取5.5gKCl固体
B.在酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后再用待测液润洗
C.将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液的pH
D.配制0.1mol•L-1的硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释难度: 中等查看答案及解析
-
常温时,将足量的AgCl固体分别加入同体积的下列各溶液中,溶解的AgCl最少的是( )
A.1 mol•L-1的MgCl2溶液
B.2 mol•L-1的NaCl溶液
C.1.4 mol•L-1的BaCl2溶液
D.1 mol•L-1的AlCl3溶液难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动必需的三大营养物质.下列说法错误的是( )
A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体
B.淀粉水解的最终产物能发生银镜反应
C.蛋白质溶液中加入硫酸铜溶液后产生的沉淀不能重新溶于水
D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠难度: 中等查看答案及解析
-
下列有关甲苯的描述中,能说明侧链对苯环性质产生影响的是( )
A.甲苯燃烧产生带浓烟的火焰
B.甲苯能使酸性KMnO4溶液褪色
C.甲苯硝化反应后生成三硝基甲苯
D.甲苯能与H2发生加成反应难度: 中等查看答案及解析
-
乙醇分子中各化学键如图所示,下列说法错误的是( )
A.和金属钠反应,键①断裂
B.与氢卤酸反应,键②断裂
C.和乙酸、浓硫酸共热时,键②断裂
D.在铜催化下和氧气反应时,键①和③断裂难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的情况下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是( )
A.NH3•H2O
B.NaOH
C.Na2CO3
D.MgO难度: 中等查看答案及解析
-
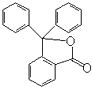
某有机物只含有C、H、O三种元素,其分子结构如图所示.下列关于该有机物的说法,正确的是( )
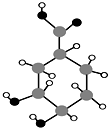
A.能使紫色石蕊试液变红
B.能发生银镜反应
C.遇FeCl3溶液呈紫色
D.能和溴水发生取代反应难度: 中等查看答案及解析
-
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性.如图有机物发生下列反应后的生成物无光学活性的是( )

A.与甲酸发生酯化反应
B.与NaOH水溶液共热
C.与银氨溶液作用
D.在催化剂存在下与H2作用难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
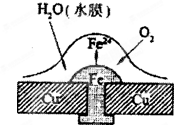
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜不被腐蚀
D.此过程中电子从Fe移向Cu难度: 中等查看答案及解析
-
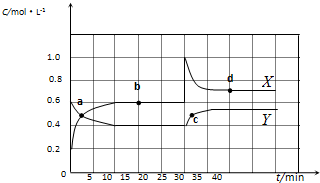
如图为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化情况,据此分析不能得出的结论是( )

A.A是反应物,B、C是生成物
B.前2 min A的分解速率为0.1mol•L-1•min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动难度: 中等查看答案及解析
-
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1
B.10:1
C.6:1
D.5:1难度: 中等查看答案及解析
-
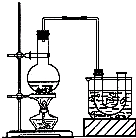
乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
CH3COOC2H5+H2O.若用如图所示的装置来制备少量的乙酸乙酯,下列因素:①乙醇挥发;②浓硫酸催化效果较差;③反应温度过高生成乙醚,能导致产率偏低的是( )
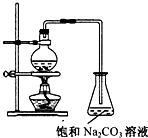
A.只有①
B.只有①②
C.只有①③
D.①②③都可以难度: 中等查看答案及解析
-
已知0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的( )
A.c (CH3COO-)>c (Na+)
B.c (Na+)+c (H+)═c (OH-)+c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01 mol•L-1难度: 中等查看答案及解析