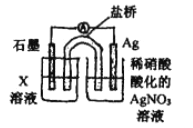
-
化学与生产、生活密切相关,下列说法不正确的是
A. 用熟石灰可处理废水中的酸
B. 用水玻璃可生产點合剂和防火剂
C. 用食盐水有利于清除炊具上残留的油污
D. 用浸泡过高锰酿钾溶液的硅藻士保鲜水果
难度: 简单查看答案及解析
-
下列反应的离子方程式正确是
A. 过氧化钠与水反应: 2O22-+ 2H2O=4OH-+O2↑
B. 用盐酸制硅胶: Na2SiO3+ 2H+=2Na++H2SiO3
C. 实验室制氯气: MnO2+4HCl(浓)
Mn2++ 2Cl-+Cl2↑+ 2H2O
D. 用NaOH溶液除去铝表面的氧化膜: Al2O3+ 2OH-=2A1O2-+H2O
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是
选项
实验
实验目的
A
将少量氯水加入到盛有NaBr溶液的试管中,振荡后加入
少量CCl4振荡、静置
比较氯、溴的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入氨气
比较镁、铝的金属性强弱
C
测定同质量的Na2CO3、Na2SiO3溶液的pH
比较两种盐的电离能强弱
D
将擦干表面煤油的Na、K小块分别放入热坩埚中,观察
燃烧时的焰色
比较钠、钾的金属性强弱
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是
A. SiF4的电子式为
B. 14C与14N两种核素中的中子数相同
C. 116号元素“鉝”位于周期表第七周期第VIA族
D. 具有非极性键的乙烯分子中各原子都满足8电子稳定结构
难度: 简单查看答案及解析
-
已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b,pH=7
B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-)
D. 混合溶液中,c(OH-)=
mol/L
难度: 中等查看答案及解析
-
用惰性电极电解如下物质可制得对应金属的是
A. 电解熔融AlCl3获取金属铝
B. 电解MgCl2溶液获取金属镁
C. 电解CuCl2溶液获取金属铜
D. 电解饱和食盐水来获取金属钠
难度: 中等查看答案及解析
-
鉴别NaCl、NaBr、NaI、NaS溶液可以选用的试剂是
A. 溴水 B. AgNO3溶液 C. 苯 D. FeCl3溶液
难度: 中等查看答案及解析
-
下列有关酸碱中和滴定实验操作或说法正确的是
A. 洗净的锥形瓶须烘干后再滴入待测液
B. 用待测溶液润洗锥形瓶可以减小误差
C. 若滴定终点时,俯视刻度线记录数据,会导致测定结果偏高
D. 满定管装待测溶液前,须先水洗,后再用该溶液润洗以减小误差
难度: 中等查看答案及解析
-
根据实验目的设计如下装置的连接中,正确的是

A. 制备收集C2H4: 连接a
c
g
B. 制备收集NO: 连接 b
c
e
d
C. 制备收集NH3:连线b
d
e
c
D. 制备收集Cl2连接a
f
c
e
d
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 食盐水中: K+、Al3+、HCO3-
B. 无色溶液中: Fe3+、SO42-、SCN-
C. c(C2O42-)=0.1mol/L的溶液中: H+、Na+、MnO4-
D. c(OH-)/(H+)=1×10-12mol/L的溶液中: NH4+、Na+、Cl-
难度: 中等查看答案及解析
-
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4
H2C2O4混合溶液。下列叙沭正确的是
A. 待加工铝质工件作阳极
B. 可选用不锈钢网作为阳极
C. 阴极的电极反应式为Al-3e-=Al3+
D. 硫酸根离子在电解过程中向阴极移动
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法确的是
A. 标准状况2.24LCCl4含有共价键数为0.4NA
B. 1LpH=1的H3PO4溶液中H+的数目为0.1NA
C. 1molN2与6molH2反应生成的NH3分子数为2NA
D. 钾与水反应生成0.1molO2时转移电子数为0.1NA
难度: 简单查看答案及解析
-
常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
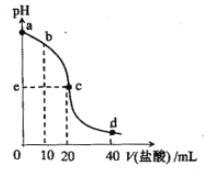
A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
难度: 困难查看答案及解析
-
常温下,Ka(CH3COOH) =2×10-5,Ka(HCOOH)=2×10-4,Kb(NH3·H2O)=2×10-5,下列说法不正确的是
A. 向0.1mol/L HCOOH溶液中加入少量水,溶液中c(H+)/c(HCOOH)增大
B. 浓度均为0.1mol/L的HCOOH和NH4Cl溶液,由水电高出的c(OH-)前者小于后者
C. 用0.1mol/L的NaOH溶液分别中和等体积等pH的HCOOH和CH3COOH溶液,消耗NaOH溶液的体积相等
D. 0.05mol/L的CH3COOH溶液中pH=3
难度: 困难查看答案及解析
-
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法确的是

A. 该装置将化学能转化为光能和电能
B. 每44gCO2被还原,有1.5molO2生成
C. 该装置工作时,H+从a极区向b极区迁移
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z、的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是
A. W的最高价氧化物的水化物为弱酸
B. Y,Z的简单离子具有相同的电子层结构
C. Z与X属于同一主族,与Y属于同一周期
D. Y与Z形成化合物的水溶液可使甲基橙变红
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
难度: 中等查看答案及解析
-
下述系列实验均有红棕色气体产生,由此得出如下的几个结论:
实验ⅰ
实验ⅱ
实验ⅲ


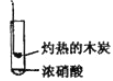
①实验ⅰ可知产生气体中只有NO2 ②实验让说明木炭被浓硝酸氧化了③实验ⅲ说明浓硝酿有挥发性④实验市产生的气体中检测出CO2,说明木炭被浓硝酸氧化了。对比分析所得结论正确的是
A. 结论① B. 结论② C. 结论③ D. 结论②④
难度: 中等查看答案及解析