-
某实验小组同学在探究Fe、Fe3+、Ag+相互间的反应时,设计了如下系列实验。已知: Ag+与SCN- 生成白色沉淀AgSCN。请按要求回答下列问题。
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
(1)由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是_______,发现有白色沉淀产生。
(2)乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为___________。
(3)由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+,其理由是(用离子方程式表示):________。
丙为证实自己的猜测,取上层清液,滴加_______,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
①“白色沉淀”是_________。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被________氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为_________
假设c:__________氧化了Fe2+,而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)_____中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
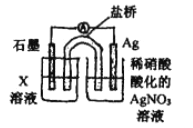
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为________溶液;该电池总反应的离子方程式为:__________。
-
已知:Ag++SCN-==== AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
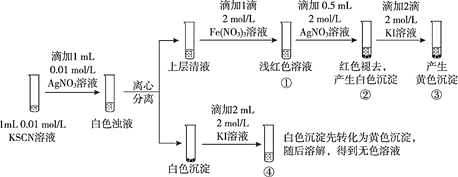
下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ ==== 3AgSCN↓+Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
-
已知:Ag++SCN-==== AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
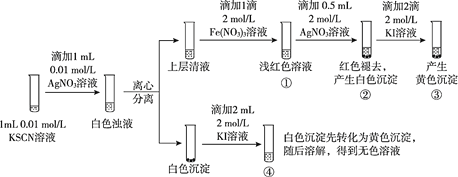
下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ ==== 3AgSCN↓+Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
-
某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
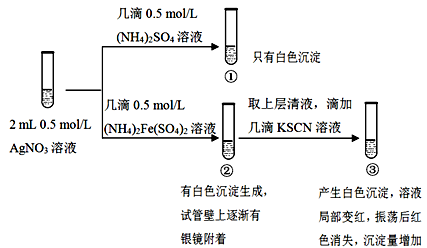
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是___________________。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________。
(3)②中可能发生的离子反应有_________________。
(4)实验①的设计目的_______________________。
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为_________________。
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:

现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:
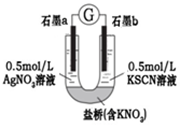
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是___________________________。
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是______。
-
某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
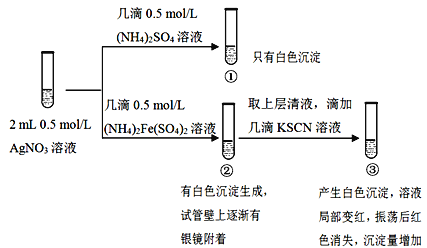
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为黄色物质。
(1)①中的白色沉淀是___________________。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________。
(3)②中生成银的离子反应可能为_________________。
(4)实验①的设计目的_______________________。
-
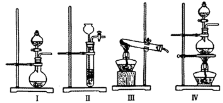
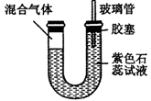
(16分)某研究性学习小组探究碳化铝的性质:发现碳化铝与水在常温下剧烈反应,生成大量气体和白色沉淀,该沉淀既能溶于盐酸也能溶于NaOH溶液,该小组同学为了探究气体产物的组成,设计出如下实验:
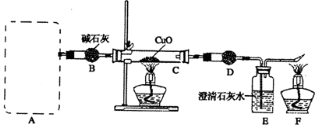
(1)利用碳化铝制取气体,下列装置中适合作为气体发生装置的是 。
(2)正确选择发生装置后,连接装置进行实验。一段时间后,硬质玻璃管C中黑色粉末变成红色,干燥管D中白色粉末变成蓝色,装置E中澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
①干燥管D中的试剂可能是 ,其作用是 。
②根据实验现象,某同学得出下列推论,其中正确的是 。
a.气体与氧化铜在一定条件下反应,氧化产物只有二氧化碳
b.气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳
c.气体与氧化铜在一定条件下反应,产物一定有水、二氧化碳和一氧化碳
d.气体具有还原性,氧化产物可能有多种
(3)实验完毕后,要先后熄灭C和F处的酒精灯,应先熄灭的是 处酒精灯,理由是 。(只写出一条即可)
(4)若最后在F处点燃气体与在A处产生的气体相同,实验前系统内的空气已排尽,实验验结束后,C装置减轻12.8 g,D装置增重7.2 g,E装置增重8.8 g(假定D、E吸收气体是完全的),则A、C处发生反应的方程式分别为 、 。
(5)如图所示,U型透明玻璃管的左端封闭有A处产生气体和氯气的混合气,将该装置放在日光灯下。一段时间后(不考虑水与氯气的反应),下列关于U型管中可能出现的现象的叙述中正确的是( )
a.U型管左侧会有油状液滴出现
b.溶液很快变成蓝色
c.气柱缩小,右端液柱下降
d.气柱膨胀,右端玻璃管中液体溢出
-
某实验小组同学设计实验,完成Cu和 Fe2(SO4)3溶液的反应,用 KSCN 溶液检验是否还存在 Fe3+。
实验 I:

已知: i. Cu2+ CuSCN↓(白色) + (SCN)2(黄色)
CuSCN↓(白色) + (SCN)2(黄色)
ii. (SCN)2的性质与卤素单质相似
iii. CuSCN溶于稀硝酸,发生反应 CuSCN+HNO3==CuSO4+N2+CO2+H2O(未配平)
(1) 依据现象i可预测该反应的离子方程式为__________________________。
(2) 该小组同学查阅资料认为现象ii中的白色沉淀可能为CuSCN,设计实验进行验证。
实验II: 取少量实验I中的白色沉淀于试管中_______________________,证明该白色沉淀为CuSCN。(补充所加试剂及实验现象)
(3)该小组同学继续探究白色沉淀的成因,进行如下实验,
实验III:
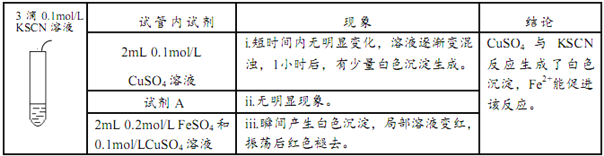
在实验III中:
①写出现象i中生成白色沉淀的离子方程式____________。
②试剂A为___________。
③根据现象iii结合化学用语及必要的文字解释Fe2+能加快沉淀生成的原因______。
(4)有的同学认为实验III不能充分证明其结论,并补充实验IV如下:
取2mL0.1 mol/L Fe2(SO4)3滴加3滴0.1mol/L KSCN溶液后,溶液变红,然后滴加2mL0.1mol/LCuSO4混合溶液于试管中, _____________________(现象)说明白色沉淀不是由Fe3+与SCN- 生成,且Fe3+不能加快CuSCN的生成。
(5)改变实验I铜的用量,设计实验V

该小组同学认为实验V中现象ii红色褪去与平衡移动有关,解释为____________。
-
某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是
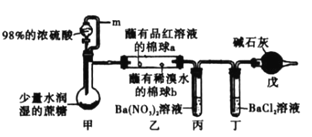
A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
-
某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+
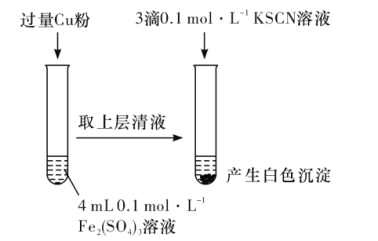
(1)Fe3+与Cu粉发生反应的离子方程式为__。
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。
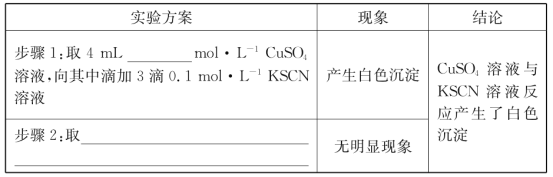
查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
-
某小组为探究 溶液和不同类型盐溶液反应的多样性,设计如图实验:
溶液和不同类型盐溶液反应的多样性,设计如图实验:
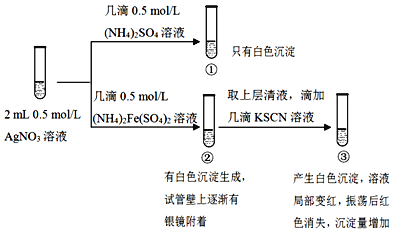
已知:AgSCN为白色难溶物。
下列说法不正确的是( )
A.①中的白色沉淀是
B.向①的试管中滴加 KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
















