-
硫及其化合物在生产、生活中有着重要的应用价值。请按要求回答下列问题。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ) 制氢的热化学方程式分别为_________;_________;制得等量H2所需能量较少的是系統_________。
(2)H2S 与CO2在高温下发生反应: H2S(g)+CO2(g)  COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
①该反应平衡后H2O(g)的物质的量分数为0.3,H2S的平衡转化率α1=____,反应平衡常数K=____。
②在350℃重复试验,平衡后H2O(g)的物质的量分数为0.4,H2S的转化率α2_____α1,(填“>”“<”或“=”)该反应的△H____0。
③测定钢铁中硫含量: 将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为____,滴定反应的离子方程式为__________。
已知25 ℃时,H2SO3的电离常数K.a1=1×10-2,Ka2=5×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/c(HSO3-)将_______(填“增大”、“减小”或“不变" ).
-
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:

(1)已知: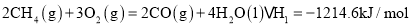

请写出 燃烧热的热化学方程式: ______ .
燃烧热的热化学方程式: ______ .
(2)在不同温度下反应 的平衡常数K如下表:
的平衡常数K如下表:
| 温度 | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 
| 
| 1 | 
| 
|
①该反应的 ______
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
②900℃时发生上述反应, 的转化率随时间变化如图所示,若到达平衡后加压,则
的转化率随时间变化如图所示,若到达平衡后加压,则 的转化率将
的转化率将 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同 ______,正反应速率将 ______. 其他条件相同时,请在图中画出
______,正反应速率将 ______. 其他条件相同时,请在图中画出 时
时 的转化率随时间变化的示意图______.
的转化率随时间变化的示意图______.
③在 时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是
时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 填编号
填编号 ______ ,平衡后与C中各物质的百分含量相等的组有 ______
______ ,平衡后与C中各物质的百分含量相等的组有 ______  填编号
填编号
| A | B | C | D | E |
| 
| 3 | 1 | 0 | 1 | 1 |
| 
| 2 | 1 | 0 | 1 | 2 |
| 
| 1 | 2 | 3 | 
| 3 |
| 
| 5 | 2 | 3 | 
| 1 |
(3)以二甲醚 、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
①假设该燃料电池中盛有
 KOH溶液,放电时参与反应的氧气在.
KOH溶液,放电时参与反应的氧气在.
②标准状况下的体积为 ,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
-
(12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产
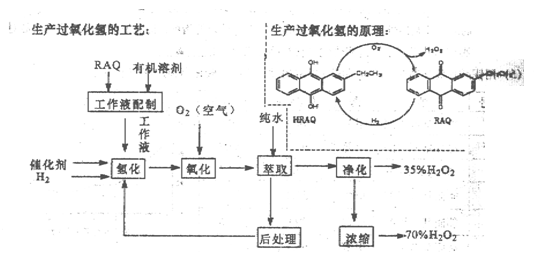
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为________。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?________
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是________。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是________。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是________。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为________。
-
含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
-
硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
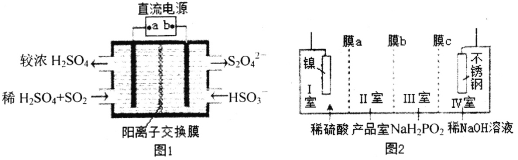
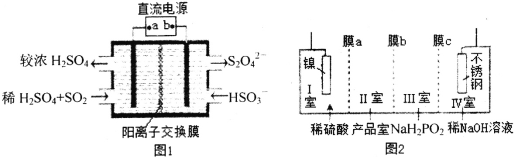
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)  2SO3(g)。
2SO3(g)。
已知:标准平衡常数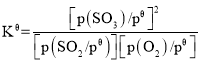 ,其中
,其中 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为 ,则
,则 _______(用含
_______(用含 的最简式表示)。
的最简式表示)。
-
硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)  2SO3(g)。
2SO3(g)。
已知:标准平衡常数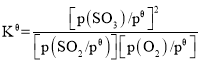 ,其中
,其中 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为 ,则
,则 _______(用含
_______(用含 的最简式表示)。
的最简式表示)。
-
镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1) 可循环使用的物质是______。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________。
(2) 检验CaO2·8H2O是否洗净的操作是________。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________。
-
铁及其化合物在生产和生活中有着广泛的应用。
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
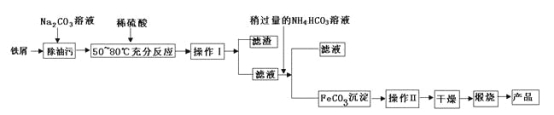
①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式__________________;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+______。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式_________________________
②计算上述样品中FeSO4·7H2O的质量分数为__________________[已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为______________________________
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
-
铁及其化合物在生产和生活中有着广泛的应用。
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
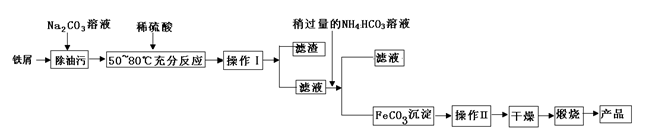
①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式________;
③煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+ 。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式________
②计算上述样品中FeSO4·7H2O的质量分数为[已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为________
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
-
化学电源在日常生活和工业生产中有着重要的应用。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题
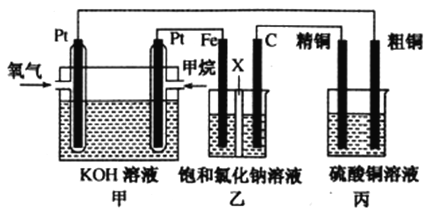
(1)甲烷燃料电池负极反应式是______________________。
(2)石墨(C)极的电极反应式为______________________。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________L;丙装置中阴极析出铜的质量为___________g,一段时间后烧杯中c(Cu2+)___________(填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:
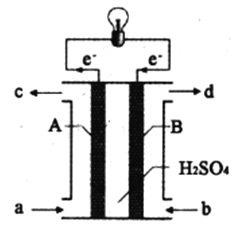
(4)从a口加入___________(填名称)。H+移动方向是___________(填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________。

COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
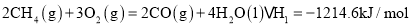



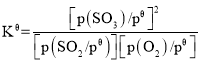 ,其中
,其中
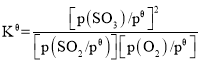 ,其中
,其中


