-
硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
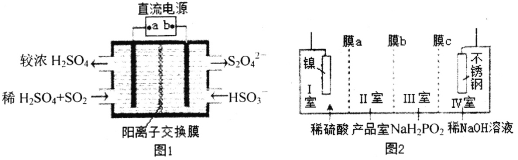
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)  2SO3(g)。
2SO3(g)。
已知:标准平衡常数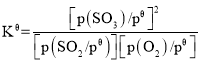 ,其中
,其中 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为 ,则
,则 _______(用含
_______(用含 的最简式表示)。
的最简式表示)。
-
硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
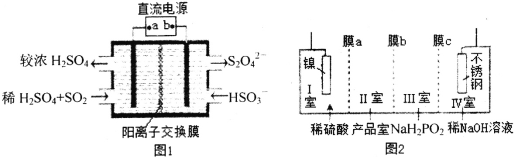
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)  2SO3(g)。
2SO3(g)。
已知:标准平衡常数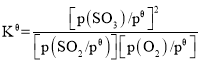 ,其中
,其中 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为 ,则
,则 _______(用含
_______(用含 的最简式表示)。
的最简式表示)。
-
硫及其化合物在生产、生活中有着重要的应用价值。请按要求回答下列问题。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ) 制氢的热化学方程式分别为_________;_________;制得等量H2所需能量较少的是系統_________。
(2)H2S 与CO2在高温下发生反应: H2S(g)+CO2(g)  COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
①该反应平衡后H2O(g)的物质的量分数为0.3,H2S的平衡转化率α1=____,反应平衡常数K=____。
②在350℃重复试验,平衡后H2O(g)的物质的量分数为0.4,H2S的转化率α2_____α1,(填“>”“<”或“=”)该反应的△H____0。
③测定钢铁中硫含量: 将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为____,滴定反应的离子方程式为__________。
已知25 ℃时,H2SO3的电离常数K.a1=1×10-2,Ka2=5×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/c(HSO3-)将_______(填“增大”、“减小”或“不变" ).
-
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l)  H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
-
碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═ H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
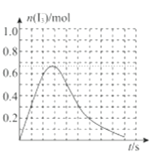
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
-
碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═ H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
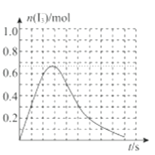
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
-
碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________(用△H1、△H2表示)。
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)  I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
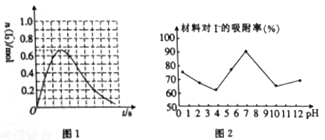
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
-
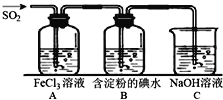
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
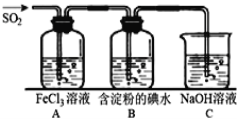
(1)写出由铜和浓硫酸制取SO2的化学方程式_______________________________。
(2)装置A中的现象是__________________________________________________。反应结束后若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在蒸发操作中要用到的主要仪器有_______(填编号)。自然干燥晶体而不烘干晶体的原因是___________________________。
A.酒精灯 B.蒸发皿 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式__________________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明SO2的还原性比I-_________(填“强”或“弱”)。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
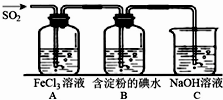
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。

2SO3(g)。
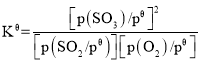 ,其中
,其中为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
,则
_______(用含
的最简式表示)。

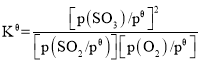 ,其中
,其中






